Wiązanie jonowe
(wykorzystano materiały ze strony http://www.hemi.nsu.ru/ucheb138.htm)
Wiązanie jonowe zachodzi poprzez przyciąganie elektrostatyczne pomiędzy przeciwnie naładowanymi jonami. Jony te powstają w wyniku przeniesienia elektronów z jednego atomu na drugi. Wiązanie jonowe powstaje między atomami, które mają duże różnice w elektroujemności (zwykle większe niż 1,7 w skali Paulinga), na przykład między atomami metalu alkalicznego i halogenu.
Rozważmy występowanie wiązania jonowego na przykładzie powstawania NaCl.
Z elektronicznych wzorów atomów
Na 1s 2 2s 2 2p 6 3s 1 i
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Można zauważyć, że aby ukończyć poziom zewnętrzny, atomowi sodu łatwiej jest oddać jeden elektron niż zyskać siedem, natomiast atomowi chloru łatwiej jest zyskać jeden elektron niż zyskać siedem. W reakcjach chemicznych atom sodu oddaje jeden elektron, a atom chloru go zabiera. W rezultacie powłoki elektronowe atomów sodu i chloru ulegają przemianie w stabilne powłoki elektronowe gazów szlachetnych (konfiguracja elektronowa kationu sodu
Na + 1s 2 2s 2 2p 6,
a konfiguracja elektronowa anionu chloru wynosi
Cl – - 1s 2 2s 2 2p 6 3s 2 3p 6).
Elektrostatyczne oddziaływanie jonów prowadzi do powstania cząsteczki NaCl.
Charakter wiązania chemicznego często odzwierciedla się w stanie skupienia i właściwościach fizycznych substancji. Związki jonowe, takie jak chlorek sodu NaCl, są twarde i ogniotrwałe, ponieważ między ładunkami ich jonów „+” i „–” działają potężne siły przyciągania elektrostatycznego.
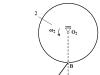
Ujemnie naładowany jon chloru przyciąga nie tylko „swój” jon Na+, ale także inne jony sodu znajdujące się wokół niego. Prowadzi to do tego, że w pobliżu żadnego z jonów nie ma jednego jonu o przeciwnym znaku, ale kilka.
Struktura kryształu chlorku sodu NaCl.
W rzeczywistości wokół każdego jonu chloru znajduje się 6 jonów sodu, a wokół każdego jonu sodu – 6 jonów chloru. To uporządkowane upakowanie jonów nazywa się kryształem jonowym. Jeżeli w krysztale wyodrębniony zostanie pojedynczy atom chloru, to wśród otaczających go atomów sodu nie da się już znaleźć tego, z którym chlor przereagował.
Przyciągane do siebie siłami elektrostatycznymi jony niezwykle niechętnie zmieniają swoje położenie pod wpływem siły zewnętrznej lub wzrostu temperatury. Jeśli jednak chlorek sodu stopi się i będzie dalej ogrzewany w próżni, odparuje, tworząc dwuatomowe cząsteczki NaCl. Sugeruje to, że siły wiązania kowalencyjnego nigdy nie są całkowicie wyłączone.
Podstawowe charakterystyki wiązań jonowych i właściwości związków jonowych
1. Wiązanie jonowe jest silnym wiązaniem chemicznym. Energia tego wiązania jest rzędu 300 – 700 kJ/mol.
2. W przeciwieństwie do wiązania kowalencyjnego, wiązanie jonowe jest bezkierunkowe, ponieważ jon może przyciągać do siebie jony o przeciwnym znaku w dowolnym kierunku.
3. W przeciwieństwie do wiązania kowalencyjnego, wiązanie jonowe jest nienasycone, ponieważ oddziaływanie jonów o przeciwnym znaku nie prowadzi do całkowitego wzajemnego wyrównania ich pól siłowych.
4. Podczas tworzenia cząsteczek z wiązaniem jonowym nie następuje całkowite przeniesienie elektronów, dlatego w przyrodzie nie ma stuprocentowych wiązań jonowych. W cząsteczce NaCl wiązanie chemiczne jest tylko w 80% jonowe.
5. Związki z wiązaniami jonowymi to krystaliczne ciała stałe o wysokich temperaturach topnienia i wrzenia.
6. Większość związków jonowych jest rozpuszczalna w wodzie. Roztwory i stopy związków jonowych przewodzą prąd elektryczny.
Połączenie metalowe
Kryształy metali mają różną strukturę. Jeśli zbadasz kawałek metalicznego sodu, przekonasz się, że jego wygląd bardzo różni się od soli kuchennej. Sód jest metalem miękkim, dającym się łatwo ciąć nożem, spłaszczać młotkiem, łatwo go stopić w kubku nad lampą alkoholową (temperatura topnienia 97,8 o C). W krysztale sodu każdy atom jest otoczony przez osiem innych podobnych atomów.

Struktura krystaliczna metalicznego Na.
Rysunek pokazuje, że atom Na w środku sześcianu ma 8 najbliższych sąsiadów. Ale to samo można powiedzieć o każdym innym atomie w krysztale, ponieważ wszystkie są takie same. Kryształ składa się z „nieskończenie” powtarzających się fragmentów pokazanych na tym rysunku.
Atomy metali na zewnętrznym poziomie energii zawierają niewielką liczbę elektronów walencyjnych. Ponieważ energia jonizacji atomów metali jest niska, elektrony walencyjne są w nich słabo zatrzymywane. W rezultacie w sieci krystalicznej metali pojawiają się dodatnio naładowane jony i wolne elektrony. W tym przypadku kationy metali zlokalizowane są w węzłach sieci krystalicznej, a elektrony poruszają się swobodnie w polu dodatnich centrów, tworząc tzw. „gaz elektronowy”.
Obecność ujemnie naładowanego elektronu pomiędzy dwoma kationami powoduje, że każdy kation oddziałuje z tym elektronem.
Zatem, Wiązanie metaliczne to wiązanie pomiędzy jonami dodatnimi w kryształach metali, które zachodzi w wyniku przyciągania elektronów poruszających się swobodnie w krysztale.
Ponieważ elektrony walencyjne w metalu są równomiernie rozmieszczone w krysztale, wiązanie metaliczne, podobnie jak wiązanie jonowe, jest wiązaniem bezkierunkowym. W przeciwieństwie do wiązania kowalencyjnego, wiązanie metaliczne jest wiązaniem nienasyconym. Wiązanie metaliczne różni się także od wiązania kowalencyjnego siłą. Energia wiązania metalicznego jest około trzy do czterech razy mniejsza niż energia wiązania kowalencyjnego.
Ze względu na dużą ruchliwość gazu elektronowego metale charakteryzują się dużą przewodnością elektryczną i cieplną.
Kryształ metalu wygląda dość prosto, ale w rzeczywistości jego struktura elektronowa jest bardziej złożona niż kryształów soli jonowej. W zewnętrznej powłoce elektronowej elementów metalowych nie ma wystarczającej liczby elektronów, aby utworzyć pełnoprawne „oktetowe” wiązanie kowalencyjne lub jonowe. Dlatego w stanie gazowym większość metali składa się z cząsteczek jednoatomowych (tj. pojedynczych atomów, które nie są ze sobą połączone). Typowym przykładem są pary rtęci. Zatem wiązanie metaliczne między atomami metalu występuje tylko w stanie skupienia w stanie ciekłym i stałym.
Wiązanie metaliczne można opisać w następujący sposób: część atomów metalu w powstałym krysztale oddaje swoje elektrony walencyjne przestrzeni między atomami (dla sodu jest to...3s1), zamieniając się w jony. Ponieważ wszystkie atomy metali w krysztale są takie same, każdy z nich ma taką samą szansę na utratę elektronu walencyjnego.
Innymi słowy, transfer elektronów pomiędzy obojętnymi i zjonizowanymi atomami metali następuje bez zużycia energii. W takim przypadku część elektronów zawsze trafia do przestrzeni między atomami w postaci „gazu elektronowego”.
Te wolne elektrony, po pierwsze, utrzymują atomy metalu w pewnej odległości równowagowej od siebie.
Po drugie, nadają metalom charakterystyczny „metaliczny połysk” (wolne elektrony mogą oddziaływać z kwantami światła).
Po trzecie, wolne elektrony zapewniają metalom dobrą przewodność elektryczną. Wysoką przewodność cieplną metali tłumaczy się także obecnością wolnych elektronów w przestrzeni międzyatomowej - łatwo „reagują” na zmiany energii i przyczyniają się do jej szybkiego przenoszenia w krysztale.

Uproszczony model struktury elektronowej kryształu metalu.
******** Na przykładzie metalicznego sodu rozważmy naturę wiązania metalicznego z punktu widzenia pomysłów na orbitale atomowe. Atom sodu, podobnie jak wiele innych metali, nie ma elektronów walencyjnych, ale istnieją wolne orbitale walencyjne. Pojedynczy elektron 3s sodu może przenieść się na dowolny z sąsiednich orbitali swobodnych i o bliskiej energii. Gdy atomy w krysztale zbliżają się do siebie, zewnętrzne orbitale sąsiednich atomów nakładają się, umożliwiając oddanym elektronom swobodne poruszanie się po krysztale.
Jednak „gaz elektronowy” nie jest tak nieuporządkowany, jak mogłoby się wydawać. Wolne elektrony w krysztale metalu znajdują się na nakładających się orbitali i są do pewnego stopnia wspólne, tworząc coś w rodzaju wiązań kowalencyjnych. Sód, potas, rubid i inne metaliczne pierwiastki S mają po prostu niewiele wspólnych elektronów, więc ich kryształy są kruche i topliwe. Wraz ze wzrostem liczby elektronów walencyjnych ogólnie wzrasta wytrzymałość metali.
Zatem wiązania metaliczne są zwykle tworzone przez pierwiastki, których atomy mają niewiele elektronów walencyjnych na swoich zewnętrznych powłokach. Te elektrony walencyjne, które wykonują wiązanie metaliczne, są tak wspólne, że mogą poruszać się po krysztale metalu i zapewniać metalowi wysoką przewodność elektryczną.
Kryształ NaCl nie przewodzi prądu, ponieważ w przestrzeni pomiędzy jonami nie ma wolnych elektronów. Wszystkie elektrony oddane przez atomy sodu są mocno trzymane przez jony chloru. Jest to jedna ze znaczących różnic między kryształami jonowymi a metalowymi.
To, co teraz wiesz o wiązaniach metalicznych, pomaga wyjaśnić wysoką plastyczność (ciągliwość) większości metali. Metal można spłaszczyć na cienki arkusz i przeciągnąć na drut. Faktem jest, że poszczególne warstwy atomów w krysztale metalu mogą stosunkowo łatwo ślizgać się po sobie: mobilny „gaz elektronowy” stale łagodzi ruch poszczególnych jonów dodatnich, osłaniając je od siebie.
Oczywiście nic takiego nie da się zrobić z solą kuchenną, choć sól też jest substancją krystaliczną. W kryształach jonowych elektrony walencyjne są ściśle związane z jądrem atomu. Przesunięcie jednej warstwy jonów względem drugiej powoduje zbliżenie do siebie jonów o tym samym ładunku i powoduje silne odpychanie między nimi, co skutkuje zniszczeniem kryształu (NaCl jest substancją kruchą).

Przesunięcie warstw kryształu jonowego powoduje pojawienie się dużych sił odpychania pomiędzy podobnymi jonami i zniszczenie kryształu.
Nawigacja
- Rozwiązywanie problemów łączonych w oparciu o ilościowe cechy substancji
- Rozwiązywanie problemów. Prawo stałości składu substancji. Obliczenia z wykorzystaniem pojęć „masa molowa” i „ilość chemiczna” substancji
Cel lekcji
- Podaj pojęcie wiązania chemicznego metalu.
- Naucz się zapisywać wzorce tworzenia wiązań metali.
- Zapoznaj się z właściwościami fizycznymi metali.
- Naucz się wyraźnie rozróżniać gatunki wiązania chemiczne .
Cele Lekcji
- Dowiedz się, jak oddziałują na siebie atomy metali
- Określ, jak wiązanie metalu wpływa na właściwości utworzonych przez nie substancji
Kluczowe terminy:
- Elektroujemność - właściwość chemiczna atomu, która jest ilościową cechą zdolności atomu w cząsteczce do przyciągania wspólnych par elektronów.
- Wiązanie chemiczne -zjawisko oddziaływania atomów, spowodowane nakładaniem się chmur elektronowych oddziałujących atomów.
- Połączenie metalowe to wiązanie w metalach pomiędzy atomami i jonami, utworzone w wyniku podziału elektronów.
- Wiązanie kowalencyjne - wiązanie chemiczne utworzone przez nałożenie się pary elektronów walencyjnych. Elektrony zapewniające połączenie nazywane są wspólną parą elektronów. Istnieją 2 typy: polarny i niepolarny.
- Wiązanie jonowe - wiązanie chemiczne powstające pomiędzy atomami niemetali, w którym wspólna para elektronów trafia do atomu o wyższej elektroujemności. W rezultacie atomy przyciągają ciała o przeciwnych ładunkach.
- Wiązanie wodorowe
- wiązanie chemiczne pomiędzy atomem elektroujemnym a atomem wodoru H związanym kowalencyjnie z innym atomem elektroujemnym. Atomy elektroujemne mogą być N, O lub F. Wiązania wodorowe mogą być międzycząsteczkowe lub wewnątrzcząsteczkowe.
PODCZAS ZAJĘĆ
Wiązanie chemiczne metalu
Zidentyfikuj elementy, które znajdują się w niewłaściwej „kolejce”. Dlaczego?
Ca Fe P K Al Mg Na
Które elementy z tabeli Mendelejew nazywają się metalami?
Dzisiaj dowiemy się, jakie właściwości mają metale i w jaki sposób zależą one od wiązania, które tworzy się pomiędzy jonami metali.
Na początek przypomnijmy sobie położenie metali w układzie okresowym?
Metale, jak wszyscy wiemy, zwykle nie występują w postaci izolowanych atomów, ale w postaci kawałka, wlewka lub produktu metalowego. Dowiedzmy się, co gromadzi atomy metali w pełnej objętości.
W przykładzie widzimy kawałek złota. A swoją drogą złoto to wyjątkowy metal. Dzięki kuciu można z czystego złota wykonać folię o grubości 0,002 mm! Ten cienki arkusz folii jest prawie przezroczysty i pod wpływem światła ma zielonkawy odcień. W rezultacie ze sztabki złota wielkości pudełka zapałek można uzyskać cienką folię, która pokryje powierzchnię kortu tenisowego.
Pod względem chemicznym wszystkie metale charakteryzują się łatwością oddawania elektronów walencyjnych, a co za tym idzie powstawaniem dodatnio naładowanych jonów i wykazują jedynie dodatnie utlenianie. Dlatego metale w stanie wolnym są reduktorami. Wspólną cechą atomów metali jest ich duży rozmiar w porównaniu z niemetalami. Elektrony zewnętrzne znajdują się w dużych odległościach od jądra i dlatego są z nim słabo połączone, dlatego łatwo je od siebie oddzielić.
Atomy większej liczby metali na poziomie zewnętrznym mają małą liczbę elektronów - 1,2,3. Elektrony te można łatwo oddzielić, a atomy metali stają się jonami.
Ме0 – n ē ⇆ Mężczyźni+
atomy metali – elektrony wew. orbity ⇆ jony metali
W ten sposób odłączone elektrony mogą przemieszczać się z jednego jonu na drugi, czyli stają się wolne, jakby łącząc je w jedną całość.Dlatego okazuje się, że wszystkie odłączone elektrony są wspólne, ponieważ nie da się tego zrozumieć który elektron należy do którego z atomów metalu.
Elektrony mogą łączyć się z kationami, wówczas chwilowo tworzą się atomy, z których następnie elektrony są odrywane. Proces ten zachodzi stale i bez przerwy. Okazuje się, że w objętości metalu atomy ulegają ciągłej przemianie w jony i odwrotnie. W tym przypadku niewielka liczba wspólnych elektronów wiąże dużą liczbę atomów i jonów metali. Ważne jest jednak, aby liczba elektronów w metalu była równa całkowitemu ładunkowi jonów dodatnich, to znaczy okazuje się, że ogólnie metal pozostaje elektrycznie obojętny.
Proces ten przedstawiono modelowo – jony metali znajdują się w chmurze elektronów. Taka chmura elektronów nazywana jest „gazem elektronowym”.
Na przykład na tym zdjęciu widzimy, jak elektrony poruszają się wśród nieruchomych jonów wewnątrz sieci krystalicznej metalu. 
Ryż. 2. Ruch elektronów
Aby lepiej zrozumieć czym jest gaz elektronowy i jak zachowuje się w reakcjach chemicznych różnych metali, obejrzyjmy ciekawy film. (w tym filmie złoto zostało wymienione tylko jako kolor!)
Teraz możemy zapisać definicję: wiązanie metaliczne to wiązanie w metalach pomiędzy atomami i jonami, utworzone przez wspólne elektrony.
Porównajmy wszystkie rodzaje połączeń, które znamy i skonsolidujmy je, aby lepiej je rozróżnić, w tym celu obejrzymy wideo.
Wiązanie metaliczne występuje nie tylko w czystych metalach, ale jest również charakterystyczne dla mieszanin różnych metali i stopów w różnych stanach skupienia.
Wiązanie metaliczne jest ważne i determinuje podstawowe właściwości metali
- przewodność elektryczna – losowy ruch elektronów w objętości metalu. Ale z niewielką różnicą potencjałów, aby elektrony poruszały się w sposób uporządkowany. Metale o najlepszej przewodności to Ag, Cu, Au, Al.
- plastyczność
Wiązania pomiędzy warstwami metalu nie są zbyt duże, co pozwala na przemieszczanie się warstw pod obciążeniem (odkształcanie metalu bez jego łamania). Najlepiej odkształcalnymi metalami (miękkimi) są Au, Ag, Cu.
- metaliczny połysk
Gaz elektronowy odbija prawie wszystkie promienie świetlne. Dlatego czyste metale tak bardzo błyszczą i najczęściej mają szary lub biały kolor. Metale będące najlepszymi reflektorami Ag, Cu, Al, Pd, Hg
Praca domowa
Ćwiczenie 1
Wybierz formuły substancji, które mają
a) kowalencyjne wiązanie polarne: Cl2, KCl, NH3, O2, MgO, CCl4, SO2;
b) z wiązaniem jonowym: HCl, KBr, P4, H2S, Na2O, CO2, CaS.
Ćwiczenie 2
Skreśl dodatek:
a) CuCl2, Al, MgS
b) N2, HCl, O2
c) Ca, CO2, Fe
d) MgCl2, NH3, H2
Sód metaliczny, lit metaliczny i inne metale alkaliczne zmieniają kolor płomienia. Metaliczny lit i jego sole nadają ogniowi barwę czerwoną, metaliczny sód i sole sodowe nadają mu barwę żółtą, metaliczny potas i jego sole nadają mu barwę fioletową, a rubid i cez nadają mu barwę fioletową, ale jaśniejszą.
Ryż. 4. Kawałek litu 
Ryż. 5. Barwienie płomieniowe metalami
Lit (Li). Lit metaliczny, podobnie jak sód metaliczny, jest metalem alkalicznym. Oba są rozpuszczalne w wodzie. Sód po rozpuszczeniu w wodzie tworzy sodę kaustyczną, bardzo mocny kwas. Kiedy metale alkaliczne rozpuszczają się w wodzie, wydziela się dużo ciepła i gazu (wodoru). Wskazane jest, aby nie dotykać takich metali rękami, ponieważ można się poparzyć.
Bibliografia
1. Lekcja na temat „Metaliczne wiązanie chemiczne”, nauczyciel chemii Tukhta Valentina Anatolyevna MOU „Szkoła średnia Yesenovichskaya”
2. F. A. Derkach „Chemia” – podręcznik naukowo-metodologiczny. – Kijów, 2008.
3. L. B. Tsvetkova „Chemia nieorganiczna” - wydanie 2, poprawione i rozszerzone. – Lwów, 2006.
4. V. V. Malinowski, P. G. Nagorny „Chemia nieorganiczna” – Kijów, 2009.
5. Glinka N.L. Chemia ogólna. – wyd. 27/Under. wyd. VA Rabinowicz. – L.: Chemia, 2008. – 704 s.
Redakcja i przesłanie: Lisnyak A.V.
Pracowałem na lekcji:
Tukhta V.A.
Lisnyak A.V.
Można zadać pytanie dotyczące współczesnej edukacji, wyrazić pomysł lub rozwiązać palący problem pod adresem Forum edukacyjne, gdzie rada edukacyjna świeżych myśli i działań spotyka się na arenie międzynarodowej. Stworzywszy blog, Chemia 8 klasa
Połączenie metalowe
W wyniku przyciągania elektrostatycznego pomiędzy kationem i anionem powstaje cząsteczka.
Wiązanie jonowe
Teorię wiązania jonowego zaproponował: 1916 ᴦ. Niemiecki naukowiec W. Kossel. Teoria ta wyjaśnia powstawanie połączeń pomiędzy atomy typowych metali i atomów typowy niemetale: CsF, CsCl, NaCl, KF, KCl, Na2O itp.
Zgodnie z tą teorią, gdy tworzy się wiązanie jonowe, atomy typowych metali oddają elektrony, a atomy typowych niemetali przyjmują elektrony.
W wyniku tych procesów atomy metali przekształcają się w cząstki naładowane dodatnio, które nazywane są jonami dodatnimi lub kationami; a atomy niemetali zamieniają się w jony ujemne - aniony. Ładunek kationu jest równy liczbie oddanych elektronów.
Atomy metali przekazują elektrony swojej zewnętrznej warstwie i powstałe jony mają pełne struktury elektronowe (przedzewnętrzna warstwa elektroniczna).
Wielkość ładunku ujemnego anionu jest równa liczbie przyjętych elektronów.
Atomy niemetali przyjmują taką liczbę elektronów, która jest dla nich niezwykle ważna uzupełnienie oktetu elektronicznego (zewnętrzna warstwa elektroniczna).
Na przykład: ogólny schemat tworzenia cząsteczki NaCl z atomów Na i C1: Na°-le = Na +1 Tworzenie jonów
Сl°+1е - = Сl -
Na +1 + Cl - = Na + Cl -
Na°+ Сl°= Na + Сl - Związek jonów
· Wiązanie między jonami jest powszechnie nazywane wiązaniem jonowym.
Związki składające się z jonów nazywane są Związki jonowe.
Suma algebraiczna ładunków wszystkich jonów w cząsteczce związku jonowego musi być równa zeru, ponieważ każda cząsteczka jest cząstką elektrycznie obojętną.
Nie ma ostrej granicy pomiędzy wiązaniami jonowymi i kowalencyjnymi. Wiązanie jonowe można uznać za skrajny przypadek polarnego wiązania kowalencyjnego, w którym powstaje wspólna para elektronów całkowicie przemieszcza się w kierunku atomu o wyższej elektroujemności.
Większość typowych atomów metali ma niewielką liczbę elektronów w zewnętrznej warstwie elektronowej (zwykle od 1 do 3); elektrony te nazywane są elektronami walencyjnymi. W atomach metali siła wiązania między elektronami walencyjnymi a jądrem jest niska, to znaczy atomy mają niską energię jonizacji. Ułatwia to utratę elektronów walencyjnych H przemiana atomów metali w dodatnio naładowane jony (kationy):
Me° -ne ® Me n +
W strukturze krystalicznej metalu elektrony walencyjne mają zdolność łatwego przemieszczania się z jednego atomu do drugiego, co prowadzi do podziału elektronów przez wszystkie sąsiednie atomy. W uproszczeniu budowę kryształu metalu można przedstawić następująco: w węzłach sieci krystalicznej znajdują się jony Me n+ i atomy Me°, a elektrony walencyjne przemieszczają się pomiędzy nimi stosunkowo swobodnie, tworząc połączenia pomiędzy wszystkimi atomami i jonami metal (ryc. 3). Jest to specjalny rodzaj wiązania chemicznego zwany wiązaniem metalicznym.
· Wiązanie metaliczne – wiązanie pomiędzy atomami i jonami metali w sieci krystalicznej, realizowane przez wspólne elektrony walencyjne.
Dzięki temu rodzajowi wiązania chemicznego metale mają pewien zestaw właściwości fizycznych i chemicznych, które odróżniają je od niemetali.
 Ryż. 3. Schemat sieci krystalicznej metali.
Ryż. 3. Schemat sieci krystalicznej metali.
Siła wiązania metalu zapewnia stabilność sieci krystalicznej i plastyczność metali (zdolność do poddawania się różnym obróbkom bez zniszczenia). Swobodny przepływ elektronów walencyjnych pozwala metalom dobrze przewodzić prąd i ciepło. Zdolność odbijania fal świetlnych (ᴛ.ᴇ. metaliczny połysk) można również wytłumaczyć strukturą sieci krystalicznej metalu.
Jednakże najbardziej charakterystycznymi właściwościami fizycznymi metali bazującymi na obecności wiązania metalicznego są:
■struktura krystaliczna;
■metaliczny połysk i nieprzezroczystość;
■plastyczność, plastyczność, topliwość;
■wysoka przewodność elektryczna i cieplna; i skłonność do tworzenia stopów.
Spoiwo metaliczne – koncepcja i rodzaje. Klasyfikacja i cechy kategorii „Połączenie metalowe” 2017, 2018.
Już sama nazwa „wiązanie metaliczne” wskazuje, że mówimy o wewnętrznej strukturze metali. Atomy większości metali na zewnętrznym poziomie energetycznym zawierają niewielką liczbę elektronów walencyjnych w porównaniu z całkowitą liczbą elektronów zewnętrznych, które są energetycznie bliskie... .
Wiązanie metaliczne opiera się na podziale elektronów walencyjnych należących nie do dwóch, ale do prawie wszystkich atomów metali w krysztale. W metalach jest znacznie mniej elektronów walencyjnych niż wolnych orbitali. Stwarza to warunki do swobodnego przemieszczania się.... .
Podstawowe informacje o naturze wiązań chemicznych w metalach można uzyskać na podstawie dwóch charakterystycznych cech w porównaniu ze związkami kowalencyjnymi i jonowymi. Metale różnią się od innych substancji przede wszystkim wysoką przewodnością elektryczną i... .
Istotne informacje o naturze wiązań chemicznych w metalach można uzyskać na podstawie dwóch ich charakterystycznych cech w porównaniu ze związkami kowalencyjnymi i jonowymi. Metale różnią się od innych substancji przede wszystkim wysoką przewodnością elektryczną i... .
Hybrydyzacja orbitali i konfiguracja przestrzenna cząsteczek Typ cząsteczki Orbitale początkowe atomu A Rodzaj hybrydyzacji Liczba orbitali hybrydowych atomu A Konfiguracja przestrzenna cząsteczki AB2 AB3 AB4 s + p s + p + p s + p + p + p sp sp2 sp3 ... .
Wiązanie metaliczne to wiązanie chemiczne spowodowane obecnością stosunkowo wolnych elektronów. Charakterystyka zarówno czystych metali, jak i ich stopów oraz związków międzymetalicznych. Mechanizm wiązania metalicznego We wszystkich węzłach sieci krystalicznej znajdują się... .
Cząsteczka to najmniejsza cząsteczka substancji, która ma swoje właściwości chemiczne. Zgodnie z teorią wiązania chemicznego stan stabilny pierwiastka odpowiada strukturze o wzorze elektronowym poziomu zewnętrznego s2p6 (argon, krypton, radon i inne). W trakcie edukacji... .
Tematyka kodyfikatora Unified State Examination: Kowalencyjne wiązanie chemiczne, jego odmiany i mechanizmy powstawania. Charakterystyka wiązań kowalencyjnych (biegunowość i energia wiązania). Wiązanie jonowe. Połączenie metalowe. Wiązanie wodorowe
Wewnątrzcząsteczkowe wiązania chemiczne
Najpierw przyjrzyjmy się wiązaniam, które powstają pomiędzy cząstkami w cząsteczkach. Takie połączenia nazywane są wewnątrzcząsteczkowy.
Wiązanie chemiczne pomiędzy atomami pierwiastków chemicznych ma charakter elektrostatyczny i powstaje w wyniku oddziaływanie elektronów zewnętrznych (walencyjnych)., w mniejszym lub większym stopniu utrzymywane przez dodatnio naładowane jądra związane atomy.
Kluczową koncepcją jest tutaj ELEKTROujemność. To właśnie określa rodzaj wiązania chemicznego między atomami i właściwości tego wiązania.
to zdolność atomu do przyciągania (utrzymywania) zewnętrzny(wartościowość) elektrony. Elektroujemność zależy od stopnia przyciągania elektronów zewnętrznych do jądra i zależy przede wszystkim od promienia atomu i ładunku jądra.
Elektroujemność trudno jednoznacznie określić. L. Pauling sporządził tabelę względnych elektroujemności (w oparciu o energie wiązań cząsteczek dwuatomowych). Najbardziej elektroujemnym pierwiastkiem jest fluor ze znaczeniem 4 .
Należy pamiętać, że w różnych źródłach można znaleźć różne skale i tabele wartości elektroujemności. Nie należy się tym niepokoić, ponieważ rolę odgrywa tworzenie wiązania chemicznego atomów i jest w przybliżeniu taki sam w każdym układzie.
Jeżeli jeden z atomów wiązania chemicznego A:B mocniej przyciąga elektrony, wówczas para elektronów przesuwa się w jego stronę. Więcej różnica elektroujemności atomów, tym bardziej przesuwa się para elektronów.
Jeżeli elektroujemności oddziałujących atomów są równe lub w przybliżeniu równe: EO(A)≈EO(B), wówczas wspólna para elektronów nie przesuwa się do żadnego z atomów: Odp.: B. To połączenie nazywa się kowalencyjne niepolarne.
Jeśli elektroujemności oddziałujących atomów różnią się, ale nieznacznie (różnica elektroujemności wynosi w przybliżeniu od 0,4 do 2: 0,4<ΔЭО<2 ), wówczas para elektronów zostaje przesunięta do jednego z atomów. To połączenie nazywa się kowalencyjny polarny .
Jeżeli elektroujemności oddziałujących atomów różnią się znacznie (różnica elektroujemności jest większa niż 2: ΔEO>2), wówczas jeden z elektronów zostaje prawie całkowicie przeniesiony na inny atom, wraz z utworzeniem jony. To połączenie nazywa się joński.
Podstawowe typy wiązań chemicznych − kowalencyjny, joński I metal komunikacja. Przyjrzyjmy się im bliżej.
Kowalencyjne wiązanie chemiczne
Wiązanie kowalencyjne – to wiązanie chemiczne , powstały z powodu utworzenie wspólnej pary elektronów A:B . Ponadto dwa atomy zachodzić na siebie orbitale atomowe. Wiązanie kowalencyjne powstaje w wyniku oddziaływania atomów o niewielkiej różnicy elektroujemności (zwykle pomiędzy dwoma niemetalami) lub atomy jednego pierwiastka.
Podstawowe właściwości wiązań kowalencyjnych
- centrum,
- nasycalność,
- biegunowość,
- polaryzowalność.
Te właściwości wiązania wpływają na właściwości chemiczne i fizyczne substancji.
Kierunek komunikacji charakteryzuje budowę chemiczną i postać substancji. Kąty między dwoma wiązaniami nazywane są kątami wiązania. Przykładowo w cząsteczce wody kąt wiązania H-O-H wynosi 104,45 o, zatem cząsteczka wody jest polarna, a w cząsteczce metanu kąt wiązania H-C-H wynosi 108 o 28′.

Nasycalność to zdolność atomów do tworzenia ograniczonej liczby kowalencyjnych wiązań chemicznych. Nazywa się liczbą wiązań, jaką może utworzyć atom.
Biegunowość wiązanie następuje w wyniku nierównomiernego rozkładu gęstości elektronów pomiędzy dwoma atomami o różnej elektroujemności. Wiązania kowalencyjne dzielą się na polarne i niepolarne.
Polaryzowalność połączenia są zdolność elektronów wiążących do przemieszczania się pod wpływem zewnętrznego pola elektrycznego(w szczególności pole elektryczne innej cząstki). Polaryzowalność zależy od ruchliwości elektronów. Im dalej elektron znajduje się od jądra, tym jest bardziej mobilny, a zatem cząsteczka jest bardziej polaryzowalna.

Kowalencyjne niepolarne wiązanie chemiczne
Istnieją 2 rodzaje wiązań kowalencyjnych – POLARNY I NIEPOLARNY .
Przykład . Rozważmy strukturę cząsteczki wodoru H2. Każdy atom wodoru na swoim zewnętrznym poziomie energii przenosi 1 niesparowany elektron. Aby wyświetlić atom, używamy struktury Lewisa - jest to schemat struktury zewnętrznego poziomu energii atomu, gdy elektrony są oznaczone kropkami. Modele struktury punktowej Lewisa są bardzo pomocne przy pracy z elementami drugiego okresu.
H. + . H = H:H
Zatem cząsteczka wodoru ma jedną wspólną parę elektronów i jedno wiązanie chemiczne H – H. Ta para elektronów nie przesuwa się do żadnego z atomów wodoru, ponieważ Atomy wodoru mają tę samą elektroujemność. To połączenie nazywa się kowalencyjne niepolarne .

Wiązanie kowalencyjne niepolarne (symetryczne). jest wiązaniem kowalencyjnym utworzonym przez atomy o równej elektroujemności (zwykle te same niemetale), a zatem o równomiernym rozkładzie gęstości elektronów pomiędzy jądrami atomów.
Moment dipolowy wiązań niepolarnych wynosi 0.
Przykłady: H2 (H-H), O2 (O=O), S 8.
Kowalencyjne polarne wiązanie chemiczne
Kowalencyjne wiązanie polarne jest wiązaniem kowalencyjnym występującym pomiędzy atomy o różnej elektroujemności (zazwyczaj, różne niemetale) i charakteryzuje się przemieszczenie wspólna para elektronów z atomem bardziej elektroujemnym (polaryzacja).
Gęstość elektronów jest przesunięta w stronę atomu bardziej elektroujemnego - dlatego pojawia się na nim częściowy ładunek ujemny (δ-), a na atomie mniej elektroujemnym pojawia się częściowy ładunek dodatni (δ+, delta +).
Im większa różnica elektroujemności atomów, tym większa biegunowość połączenia i nie tylko moment dipolowy . Dodatkowe siły przyciągające działają pomiędzy sąsiednimi cząsteczkami i ładunkami o przeciwnych znakach, co zwiększa się wytrzymałość komunikacja.
Polaryzacja wiązania wpływa na właściwości fizyczne i chemiczne związków. Mechanizmy reakcji, a nawet reaktywność sąsiednich wiązań zależą od polarności wiązania. Często decyduje polaryzacja połączenia polarność cząsteczki a tym samym bezpośrednio wpływa na takie właściwości fizyczne jak temperatura wrzenia i topnienia, rozpuszczalność w rozpuszczalnikach polarnych.
Przykłady: HCl, CO2, NH3.
Mechanizmy tworzenia wiązań kowalencyjnych
Kowalencyjne wiązania chemiczne mogą powstawać poprzez 2 mechanizmy:
1. Mechanizm wymiany tworzenie kowalencyjnego wiązania chemicznego ma miejsce, gdy każda cząstka dostarcza jeden niesparowany elektron, tworząc wspólną parę elektronów:
A . + . B= A:B
2. Tworzenie wiązania kowalencyjnego to mechanizm, w którym jedna z cząstek dostarcza samotną parę elektronów, a druga cząstka zapewnia wolny orbital dla tej pary elektronów:
A: + B= A:B

W tym przypadku jeden z atomów dostarcza samotną parę elektronów ( dawca), a drugi atom zapewnia wolny orbital dla tej pary ( akceptor). W wyniku powstania obu wiązań energia elektronów maleje, tj. jest to korzystne dla atomów.
Wiązanie kowalencyjne utworzone przez mechanizm donor-akceptor nie jest inny we właściwościach innych wiązań kowalencyjnych utworzonych w wyniku mechanizmu wymiany. Tworzenie wiązania kowalencyjnego przez mechanizm donor-akceptor jest typowe dla atomów albo z dużą liczbą elektronów na zewnętrznym poziomie energii (donory elektronów), albo odwrotnie, z bardzo małą liczbą elektronów (akceptory elektronów). Zdolności wartościowe atomów omówiono bardziej szczegółowo w odpowiedniej sekcji.
Wiązanie kowalencyjne powstaje w wyniku mechanizmu donor-akceptor:
- w cząsteczce tlenek węgla CO(wiązanie w cząsteczce jest potrójne, 2 wiązania powstają w wyniku mechanizmu wymiany, jedno w mechanizmie donor-akceptor): C≡O;
- V jon amonowy NH 4 +, w jonach aminy organiczne na przykład w jonie metyloamoniowym CH3-NH2+;
- V złożone związki, wiązanie chemiczne między atomem centralnym a grupami ligandów, na przykład w tetrahydroksoglinianie sodu wiązanie Na między jonami glinu i wodorotlenku;
- V kwas azotowy i jego sole- azotany: HNO 3, NaNO 3, w niektórych innych związkach azotu;

- w cząsteczce ozon O3.
Podstawowe cechy wiązań kowalencyjnych
Wiązania kowalencyjne zwykle tworzą się pomiędzy atomami niemetali. Główne cechy wiązania kowalencyjnego to długość, energia, krotność i kierunkowość.
Wielość wiązań chemicznych
Wielość wiązań chemicznych - Ten liczba wspólnych par elektronów między dwoma atomami w związku. Wielość wiązania można dość łatwo określić na podstawie wartości atomów tworzących cząsteczkę.
Na przykład , w cząsteczce wodoru H2 krotność wiązań wynosi 1, ponieważ Każdy wodór ma tylko 1 niesparowany elektron na swoim zewnętrznym poziomie energii, dlatego powstaje jedna wspólna para elektronów.
W cząsteczce tlenu O 2 krotność wiązań wynosi 2, ponieważ Każdy atom na zewnętrznym poziomie energii ma 2 niesparowane elektrony: O=O.
W cząsteczce azotu N2 krotność wiązań wynosi 3, ponieważ pomiędzy każdym atomem znajdują się 3 niesparowane elektrony na zewnętrznym poziomie energii, a atomy tworzą 3 wspólne pary elektronów N≡N.
Długość wiązania kowalencyjnego
Długość wiązania chemicznego
jest odległością między środkami jąder atomów tworzących wiązanie. Określa się ją eksperymentalnymi metodami fizycznymi. Długość wiązania można w przybliżeniu oszacować za pomocą reguły addytywności, zgodnie z którą długość wiązania w cząsteczce AB jest w przybliżeniu równa połowie sumy długości wiązań w cząsteczkach A 2 i B 2: 
Długość wiązania chemicznego można z grubsza oszacować przez promienie atomowe tworzenie wiązania lub poprzez wielość komunikacyjną, jeśli promienie atomów nie różnią się zbytnio.
Wraz ze wzrostem promieni atomów tworzących wiązanie wzrastać będzie jego długość.
Na przykład
Wraz ze wzrostem krotności wiązań między atomami (których promienie atomowe nie różnią się lub różnią się tylko nieznacznie), długość wiązania będzie się zmniejszać.
Na przykład . W szeregu: C–C, C=C, C≡C długość wiązania maleje.
Energia komunikacji
Miarą siły wiązania chemicznego jest energia wiązania. Energia komunikacji określona przez energię potrzebną do rozerwania wiązania i usunięcia atomów tworzących to wiązanie na nieskończenie dużą odległość od siebie.
Wiązanie kowalencyjne jest bardzo trwałe. Jego energia waha się od kilkudziesięciu do kilkuset kJ/mol. Im wyższa energia wiązania, tym większa siła wiązania i odwrotnie.
Siła wiązania chemicznego zależy od długości wiązania, polarności wiązania i krotności wiązań. Im dłuższe wiązanie chemiczne, tym łatwiej je rozerwać, a im niższa energia wiązania, tym mniejsza jest jego wytrzymałość. Im krótsze wiązanie chemiczne, tym jest ono silniejsze i tym większa jest energia wiązania.
Na przykład, w szeregu związków HF, HCl, HBr od lewej do prawej, siła wiązania chemicznego maleje, ponieważ Długość połączenia wzrasta.
Jonowe wiązanie chemiczne

Wiązanie jonowe jest wiązaniem chemicznym opartym na elektrostatyczne przyciąganie jonów.
Jony powstają w procesie przyjmowania lub oddawania elektronów przez atomy. Na przykład atomy wszystkich metali słabo utrzymują elektrony z zewnętrznego poziomu energii. Dlatego atomy metali charakteryzują się właściwości regeneracyjne- zdolność do oddawania elektronów.

Przykład. Atom sodu zawiera 1 elektron na poziomie energetycznym 3. Łatwo go oddając, atom sodu tworzy znacznie trwalszy jon Na +, o konfiguracji elektronowej neonu gazu szlachetnego Ne. Jon sodu zawiera 11 protonów i tylko 10 elektronów, zatem całkowity ładunek jonu wynosi -10+11 = +1:
+11Nie) 2 ) 8 ) 1 - 1e = +11 Nie +) 2 ) 8
Przykład. Atom chloru na swoim zewnętrznym poziomie energetycznym zawiera 7 elektronów. Aby uzyskać konfigurację stabilnego, obojętnego atomu argonu Ar, chlor musi zyskać 1 elektron. Po dodaniu elektronu powstaje stabilny jon chloru, składający się z elektronów. Całkowity ładunek jonu wynosi -1:
+17kl) 2 ) 8 ) 7 + 1e = +17 kl — ) 2 ) 8 ) 8
Notatka:
- Właściwości jonów różnią się od właściwości atomów!
- Stabilne jony mogą tworzyć się nie tylko atomy, ale również grupy atomów. Na przykład: jon amonowy NH 4 +, jon siarczanowy SO 4 2- itp. Wiązania chemiczne utworzone przez takie jony są również uważane za jonowe;
- Wiązania jonowe zwykle tworzą się między sobą metale I niemetale(grupy niemetalowe);
Powstałe jony są przyciągane na skutek przyciągania elektrycznego: Na + Cl -, Na 2 + SO 4 2-.
Podsumujmy wizualnie Różnica między rodzajami wiązań kowalencyjnych i jonowych:


Połączenie metalowe jest połączeniem utworzonym względnie wolne elektrony między jony metali, tworząc sieć krystaliczną.
Atomy metali zwykle znajdują się na zewnętrznym poziomie energetycznym od jednego do trzech elektronów. Promienie atomów metali z reguły są duże - dlatego atomy metali, w przeciwieństwie do niemetali, dość łatwo oddają swoje zewnętrzne elektrony, tj. są silnymi środkami redukującymi.
Oddając elektrony, atomy metali zamieniają się w jony naładowane dodatnio . Odłączone elektrony są stosunkowo wolne ruszają się pomiędzy dodatnio naładowanymi jonami metali. Pomiędzy tymi cząsteczkami powstaje połączenie, ponieważ wspólne elektrony utrzymują razem kationy metali ułożone warstwowo , tworząc w ten sposób dość silny metalowa sieć krystaliczna . W tym przypadku elektrony poruszają się w sposób ciągły chaotycznie, tj. Stale pojawiają się nowe neutralne atomy i nowe kationy.

Oddziaływania międzycząsteczkowe
Osobno warto rozważyć interakcje zachodzące między poszczególnymi cząsteczkami substancji - oddziaływania międzycząsteczkowe . Oddziaływania międzycząsteczkowe to rodzaj oddziaływania pomiędzy atomami obojętnymi, w którym nie pojawiają się nowe wiązania kowalencyjne. Siły oddziaływania między cząsteczkami zostały odkryte przez Van der Waalsa w 1869 roku i nazwane jego imieniem Siły Van dar Waalsa. Siły Van der Waalsa dzielą się na orientacja, wprowadzenie I dyspersyjny . Energia oddziaływań międzycząsteczkowych jest znacznie mniejsza niż energia wiązań chemicznych.
Orientacyjne siły przyciągania zachodzą pomiędzy cząsteczkami polarnymi (oddziaływanie dipol-dipol). Siły te występują pomiędzy cząsteczkami polarnymi. Oddziaływania indukcyjne jest oddziaływaniem pomiędzy cząsteczką polarną i niepolarną. Cząsteczka niepolarna ulega polaryzacji w wyniku działania cząsteczki polarnej, która generuje dodatkowe przyciąganie elektrostatyczne.
Szczególnym rodzajem interakcji międzycząsteczkowych są wiązania wodorowe. - są to międzycząsteczkowe (lub wewnątrzcząsteczkowe) wiązania chemiczne powstające pomiędzy cząsteczkami posiadającymi silnie polarne wiązania kowalencyjne - H-F, H-O lub H-N. Jeśli w cząsteczce są takie wiązania, to między cząsteczkami będą dodatkowe siły przyciągające .
Mechanizm edukacyjny wiązanie wodorowe jest częściowo elektrostatyczne, a częściowo donor-akceptor. W tym przypadku donorem pary elektronów jest atom pierwiastka silnie elektroujemnego (F, O, N), a akceptorem są połączone z tymi atomami atomy wodoru. Wiązania wodorowe charakteryzują się centrum w kosmosie i nasycenie
Wiązania wodorowe można oznaczyć kropkami: H ··· O. Im większa elektroujemność atomu związanego z wodorem i im mniejszy jest jego rozmiar, tym silniejsze jest wiązanie wodorowe. Jest to typowe przede wszystkim dla połączeń fluor z wodorem , a także do tlen i wodór , mniej azot z wodorem .

Wiązania wodorowe występują pomiędzy następującymi substancjami:
— fluorowodór HF(gaz, roztwór fluorowodoru w wodzie – kwas fluorowodorowy), woda H 2 O (para wodna, lód, woda w stanie ciekłym):
— roztwór amoniaku i amin organicznych- pomiędzy cząsteczkami amoniaku i wody;
— związki organiczne, w których występują wiązania O-H lub N-H: alkohole, kwasy karboksylowe, aminy, aminokwasy, fenole, anilina i jej pochodne, białka, roztwory węglowodanów - monosacharydów i disacharydów.
Wiązania wodorowe wpływają na właściwości fizyczne i chemiczne substancji. Zatem dodatkowe przyciąganie między cząsteczkami utrudnia wrzenie substancji. Substancje posiadające wiązania wodorowe wykazują nieprawidłowy wzrost temperatury wrzenia.
Na przykład Z reguły wraz ze wzrostem masy cząsteczkowej obserwuje się wzrost temperatury wrzenia substancji. Jednak w wielu substancjach H 2 O-H 2 S-H 2 Se-H 2 Te nie obserwujemy liniowej zmiany temperatur wrzenia.

Mianowicie o godz temperatura wrzenia wody jest nienormalnie wysoka - nie mniej niż -61 o C, jak pokazuje nam linia prosta, ale znacznie więcej, +100 o C. Anomalię tę tłumaczy się obecnością wiązań wodorowych pomiędzy cząsteczkami wody. Dlatego w normalnych warunkach (0-20 o C) woda jest płyn według stanu fazowego.
Połączenie metalowe. Właściwości wiązania metalicznego.
Wiązanie metaliczne to wiązanie chemiczne spowodowane obecnością stosunkowo wolnych elektronów. Charakterystyka zarówno czystych metali, jak i ich stopów oraz związków międzymetalicznych.
Metalowy mechanizm łączący
Dodatnie jony metali znajdują się we wszystkich węzłach sieci krystalicznej. Pomiędzy nimi elektrony walencyjne poruszają się losowo, niczym cząsteczki gazu odłączone od atomów podczas tworzenia jonów. Elektrony te działają jak cement, utrzymując razem jony dodatnie; w przeciwnym razie sieć rozpadłaby się pod wpływem sił odpychania pomiędzy jonami. Jednocześnie elektrony są zatrzymywane przez jony w sieci krystalicznej i nie mogą jej opuścić. Siły sprzęgające nie są zlokalizowane ani skierowane. Z tego powodu w większości przypadków pojawiają się wysokie liczby koordynacyjne (na przykład 12 lub 8). Kiedy dwa atomy metalu zbliżają się do siebie, orbitale w ich zewnętrznych powłokach nakładają się, tworząc orbitale molekularne. Jeśli zbliża się trzeci atom, jego orbital pokrywa się z orbitalami pierwszych dwóch atomów, tworząc kolejny orbital molekularny. Kiedy jest wiele atomów, powstaje ogromna liczba trójwymiarowych orbitali molekularnych, rozciągających się we wszystkich kierunkach. Ze względu na wiele nakładających się orbitali, na elektrony walencyjne każdego atomu wpływa wiele atomów.
Charakterystyczne sieci krystaliczne
Większość metali tworzy jedną z następujących wysoce symetrycznych sieci z gęstym upakowaniem atomów: sześcienną skupioną na ciele, sześcienną skupioną na twarzy i sześciokątną.
W siatce sześciennej skupionej na ciele (bcc) atomy znajdują się w wierzchołkach sześcianu, a jeden atom w środku objętości sześcianu. Metale mają sześcienną siatkę skupioną wokół ciała: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba itp.
W siatce sześciennej skupionej na ścianie (fcc) atomy znajdują się w wierzchołkach sześcianu i w środku każdej ściany. Metale tego typu mają siatkę: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co itp.
W siatce sześciokątnej atomy znajdują się w wierzchołkach i środkach sześciokątnych podstaw pryzmatu, a trzy atomy znajdują się w środkowej płaszczyźnie pryzmatu. Metale mają takie upakowanie atomów: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca itp.
Inne właściwości
Swobodnie poruszające się elektrony powodują wysoką przewodność elektryczną i cieplną. Substancje posiadające wiązanie metaliczne często łączą wytrzymałość z plastycznością, ponieważ gdy atomy są przesunięte względem siebie, wiązania nie pękają. Kolejną ważną właściwością jest metaliczna aromatyczność.
Metale dobrze przewodzą ciepło i prąd, są wystarczająco mocne i można je odkształcać bez zniszczenia. Niektóre metale są plastyczne (można je kuć), inne są plastyczne (można z nich wyciągnąć drut). Te unikalne właściwości tłumaczy się specjalnym rodzajem wiązania chemicznego, które łączy ze sobą atomy metali - wiązaniem metalicznym.
Metale w stanie stałym występują w postaci kryształów jonów dodatnich, jakby „unosiły się” w morzu swobodnie przemieszczających się między nimi elektronów.
Wiązanie metaliczne wyjaśnia właściwości metali, w szczególności ich wytrzymałość. Pod wpływem siły odkształcającej siatka metalowa może zmieniać swój kształt bez pękania, w przeciwieństwie do kryształów jonowych.
Wysoką przewodność cieplną metali tłumaczy się faktem, że jeśli kawałek metalu zostanie podgrzany z jednej strony, energia kinetyczna elektronów wzrośnie. Ten wzrost energii będzie rozprzestrzeniał się w „morzu elektronów” w całej próbce z dużą prędkością.
Przewodność elektryczna metali również staje się jasna. Jeśli na końce próbki metalu zostanie przyłożona różnica potencjałów, chmura zdelokalizowanych elektronów przesunie się w kierunku potencjału dodatniego: ten przepływ elektronów poruszających się w jednym kierunku reprezentuje znany prąd elektryczny.
Połączenie metalowe. Właściwości wiązania metalicznego. - koncepcja i rodzaje. Klasyfikacja i cechy kategorii „Wiązanie metaliczne. Właściwości wiązania metalicznego”. 2017, 2018.