Ionos kötés
(a http://www.hemi.nsu.ru/ucheb138.htm webhelyről származó anyagokat használtuk)
Az ionkötés az ellentétes töltésű ionok elektrosztatikus vonzása révén jön létre. Ezek az ionok az elektronok egyik atomról a másikra való átvitelének eredményeként jönnek létre. Ionos kötés jön létre olyan atomok között, amelyek elektronegativitásában nagy különbségek vannak (általában nagyobb, mint 1,7 a Pauling-skálán), például az alkálifém- és a halogénatomok között.
Tekintsük az ionos kötés létrejöttét a NaCl képződésének példáján.
Az atomok elektronikus képleteiből
Na 1s 2 2s 2 2p 6 3s 1 és
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Látható, hogy a külső szint teljesítéséhez egy nátriumatomnak könnyebb egy elektront feladnia, mint hetet nyerni, a klóratomnak pedig könnyebb egy elektront, mint hetet. A kémiai reakciókban a nátriumatom egy elektront ad fel, a klóratom pedig felveszi azt. Ennek eredményeként a nátrium- és klóratomok elektronhéjai nemesgázokból álló stabil elektronhéjakká alakulnak (a nátriumkation elektronikus konfigurációja)
Na + 1s 2 2s 2 2p 6,
és a klóranion elektronikus konfigurációja az
Cl – - 1s 2 2s 2 2p 6 3s 2 3p 6).
Az ionok elektrosztatikus kölcsönhatása NaCl molekula kialakulásához vezet.
A kémiai kötés természete gyakran tükröződik az anyag aggregációs állapotában és fizikai tulajdonságaiban. Az ionos vegyületek, például a nátrium-klorid NaCl kemények és tűzállóak, mivel a „+” és „–” ionjaik töltései között erős elektrosztatikus vonzási erők lépnek fel.
A negatív töltésű klórion nemcsak „a” Na+ ionját vonzza magához, hanem a többi nátriumiont is magához. Ez oda vezet, hogy bármelyik ion közelében nem egy ellentétes előjelű ion van, hanem több.
A nátrium-klorid NaCl kristályának szerkezete.
Valójában minden klórion körül 6 nátriumion van, minden nátriumion körül pedig 6 klórion. Ezt a rendezett ioncsomagolást ionkristálynak nevezzük. Ha egy kristályban egyetlen klóratomot izolálunk, akkor az azt körülvevő nátriumatomok között már nem lehet megtalálni azt, amellyel a klór reagált.
Az elektrosztatikus erők által egymáshoz vonzódva az ionok rendkívül nem szívesen változtatják helyüket külső erő vagy hőmérséklet-emelkedés hatására. De ha a nátrium-kloridot megolvasztják és vákuumban tovább hevítik, az elpárolog, és kétatomos NaCl-molekulákat képez. Ez arra utal, hogy a kovalens kötési erők soha nem kapcsolódnak ki teljesen.
Az ionos kötések alapvető jellemzői és az ionos vegyületek tulajdonságai
1. Az ionos kötés erős kémiai kötés. Ennek a kötésnek az energiája 300-700 kJ/mol nagyságrendű.
2. A kovalens kötéstől eltérően az ionos kötés nem irányú, mert az ion bármilyen irányban képes magához vonzani az ellenkező előjelű ionokat.
3. A kovalens kötéstől eltérően az ionos kötés telítetlen, mivel az ellenkező előjelű ionok kölcsönhatása nem vezet az erőtereik teljes kölcsönös kompenzálásához.
4. Az ionos kötéssel rendelkező molekulák kialakulása során nem megy végbe az elektronok teljes átadása, ezért száz százalékos ionkötések nem léteznek a természetben. A NaCl molekulában a kémiai kötés csak 80%-ban ionos.
5. Az ionos kötésekkel rendelkező vegyületek magas olvadáspontú és forráspontú kristályos szilárd anyagok.
6. A legtöbb ionos vegyület vízben oldódik. Az ionos vegyületek oldatai és olvadékai elektromos áramot vezetnek.
Fém csatlakozás
A fémkristályok eltérő szerkezetűek. Ha megvizsgál egy darab nátrium-fémet, azt tapasztalja, hogy megjelenése nagyon különbözik a konyhasóétól. A nátrium puha fém, késsel könnyen vágható, kalapáccsal lapítjuk, alkohollámpán csészében könnyen megolvasztható (olvadáspont 97,8 o C). A nátriumkristályban minden atomot nyolc másik hasonló atom vesz körül.

A fémes Na kristályszerkezete.
Az ábrán látható, hogy a kocka közepén lévő Na atomnak 8 legközelebbi szomszédja van. De ugyanez elmondható a kristály bármely más atomjáról is, mivel ezek mind egyformák. A kristály az ábrán látható "végtelenül" ismétlődő töredékekből áll.
A külső energiaszinten lévő fématomok kis számú vegyértékelektront tartalmaznak. Mivel a fématomok ionizációs energiája alacsony, a vegyértékelektronok gyengén megmaradnak ezekben az atomokban. Ennek eredményeként a fémek kristályrácsában pozitív töltésű ionok és szabad elektronok jelennek meg. Ebben az esetben a fémkationok a kristályrács csomópontjaiban helyezkednek el, és az elektronok szabadon mozognak a pozitív centrumok terén, létrehozva az úgynevezett „elektrongázt”.
Egy negatív töltésű elektron jelenléte két kation között azt okozza, hogy mindegyik kation kölcsönhatásba lép ezzel az elektronnal.
És így, A fémes kötés a fémkristályokban lévő pozitív ionok közötti kötés, amely a kristályban szabadon mozgó elektronok vonzása révén jön létre.
Mivel a fémben lévő vegyértékelektronok egyenletesen oszlanak el a kristályban, a fémes kötés, akárcsak az ionos kötés, nem irányított kötés. A kovalens kötéstől eltérően a fémes kötés telítetlen kötés. A fémkötés erősségében is különbözik a kovalens kötéstől. A fémes kötés energiája körülbelül három-négyszer kisebb, mint a kovalens kötés energiája.
Az elektrongáz nagy mobilitása miatt a fémeket nagy elektromos és hővezető képesség jellemzi.
A fémkristály meglehetősen egyszerűnek tűnik, de valójában az elektronikus szerkezete összetettebb, mint az ionos sókristályoké. A fémelemek külső elektronhéjában nincs elég elektron ahhoz, hogy teljes értékű „oktett” kovalens vagy ionos kötést hozzon létre. Ezért gázhalmazállapotban a legtöbb fém egyatomos molekulákból áll (azaz egyedi atomokból, amelyek nem kapcsolódnak egymáshoz). Tipikus példa a higanygőz. Így a fématomok közötti fémkötés csak folyékony és szilárd halmazállapotban jön létre.
A fémes kötés a következőképpen írható le: a létrejövő kristályban a fématomok egy része átadja vegyértékelektronjait az atomok közötti térnek (nátriumnál ez...3s1), ionokká alakulva. Mivel egy kristályban minden fématom azonos, mindegyiknek egyenlő esélye van egy vegyértékelektron elvesztésére.
Más szóval, az elektronok átvitele semleges és ionizált fématomok között energiafelhasználás nélkül megy végbe. Ebben az esetben néhány elektron mindig az atomok közötti térbe kerül „elektrongáz” formájában.
Ezek a szabad elektronok először is bizonyos egyensúlyi távolságra tartják egymástól a fématomokat.
Másodszor, jellegzetes „fémes fényt” adnak a fémeknek (a szabad elektronok kölcsönhatásba léphetnek a fénykvantumokkal).
Harmadszor, a szabad elektronok jó elektromos vezetőképességű fémeket biztosítanak. A fémek magas hővezető képességét a szabad elektronok jelenléte is magyarázza az atomközi térben - könnyen „reagálnak” az energiaváltozásokra, és hozzájárulnak annak gyors átviteléhez a kristályban.

Egy fémkristály elektronszerkezetének egyszerűsített modellje.
******** Példaként a fém-nátriumot használva vizsgáljuk meg a fémes kötés természetét az atompályákra vonatkozó elképzelések szempontjából. A nátriumatomban, mint sok más fémben, hiányoznak a vegyértékelektronok, de vannak szabad vegyértékpályák. A nátrium egyetlen 3s elektronja képes a szabad és közeli energiájú szomszédos pályák bármelyikére mozogni. Ahogy a kristály atomjai közelebb kerülnek egymáshoz, a szomszédos atomok külső pályái átfedik egymást, lehetővé téve az átadott elektronok szabad mozgását a kristályban.
Az „elektrongáz” azonban nem olyan rendetlen, mint amilyennek látszik. A fémkristályban lévő szabad elektronok átfedő pályákon vannak, és bizonyos mértékig megoszlanak, így kovalens kötésekhez hasonlókat alkotnak. A nátriumnak, káliumnak, rubídiumnak és más fémes s-elemeknek egyszerűen kevés megosztott elektronja van, így kristályaik törékenyek és olvadékonyak. A vegyértékelektronok számának növekedésével a fémek szilárdsága általában nő.
Így a fémes kötéseket általában olyan elemek alkotják, amelyek atomjainak külső héjában kevés vegyértékelektron található. Ezek a vegyértékelektronok, amelyek a fémes kötést végzik, annyira megoszlanak, hogy képesek mozogni a fémkristályban, és magas elektromos vezetőképességet biztosítanak a fémnek.
A NaCl kristály nem vezet elektromosságot, mert az ionok közötti térben nincsenek szabad elektronok. A nátriumatomok által adományozott összes elektront szilárdan tartják a klórionok. Ez az egyik jelentős különbség az ionos kristályok és a fémkristályok között.
A fémes kötésről jelenleg ismert ismeretei megmagyarázzák a legtöbb fém nagy alakíthatóságát (hajlékonyságát). A fémből vékony lemezt lehet lapítani és huzalba húzni. A helyzet az, hogy egy fémkristályban az egyes atomrétegek viszonylag könnyen elcsúszhatnak egymáson: a mozgó „elektrongáz” folyamatosan lágyítja az egyes pozitív ionok mozgását, védve őket egymástól.
A konyhasóval persze ilyesmit nem lehet csinálni, pedig a só is kristályos anyag. Az ionos kristályokban a vegyértékelektronok szorosan kötődnek az atommaghoz. Az egyik ionréteg eltolódása a másikhoz képest az azonos töltésű ionokat közelebb hozza egymáshoz, és erős taszítást vált ki közöttük, ami a kristály tönkremeneteléhez vezet (a NaCl törékeny anyag).

Az ionos kristály rétegeinek eltolódása a hasonló ionok között nagy taszító erők megjelenését és a kristály pusztulását okozza.
Navigáció
- Kombinált feladatok megoldása egy anyag mennyiségi jellemzői alapján
- Problémamegoldás. Az anyagok összetételének állandóságának törvénye. Számítások egy anyag „móltömege” és „kémiai mennyisége” fogalmát használva
Az óra célja
- Adjon ötletet a fémek kémiai kötéséről.
- Tanuld meg leírni a fémkötések kialakulásának mintáit.
- Ismerkedjen meg a fémek fizikai tulajdonságaival.
- Tanuld meg világosan megkülönböztetni a fajokat kémiai kötések .
Az óra céljai
- Tudja meg, hogyan lépnek kapcsolatba egymással fém atomok
- Határozza meg, hogyan befolyásolja a fémkötés az általa képzett anyagok tulajdonságait!
Kulcsfontossagu kifejezesek:
- Elektronegativitás - az atom kémiai tulajdonsága, amely a molekulában lévő atom azon képességének mennyiségi jellemzője, hogy közös elektronpárokat vonzzon.
- Kémiai kötés -az atomok kölcsönhatásának jelensége, az egymásra ható atomok elektronfelhőinek átfedése miatt.
- Fém csatlakozás egy kötés a fémekben atomok és ionok között, amely elektronok megosztásával jön létre.
- Kovalens kötés - vegyértékelektronpár átfedésével létrejövő kémiai kötés. A kapcsolatot biztosító elektronokat közös elektronpárnak nevezzük. 2 típusa van: poláris és nem poláris.
- Ionos kötés - nemfémes atomok között létrejövő kémiai kötés, amelyben egy megosztott elektronpár egy nagyobb elektronegativitású atomhoz megy. Ennek eredményeként az atomok úgy vonzzák egymást, mint az ellentétes töltésű testek.
- Hidrogén kötés
- kémiai kötés egy elektronegatív atom és egy másik elektronegatív atomhoz kovalensen kötődő H hidrogénatom között. Az elektronegatív atomok lehetnek N, O vagy F. A hidrogénkötések lehetnek intermolekulárisak vagy intramolekulárisak.
AZ ÓRÁK ALATT
Fém kémiai kötés
Azonosítsa azokat az elemeket, amelyek rossz „sorban” vannak.
Ca Fe P K Al Mg Na
Mely elemek a táblázatból Mengyelejev fémeknek nevezik?
Ma megtudjuk, milyen tulajdonságaik vannak a fémeknek, és hogyan függenek a fémionok között kialakuló kötéstől.
Először is, emlékezzünk a fémek helyére a periódusos rendszerben?
A fémek, mint mindannyian tudjuk, általában nem izolált atomok formájában léteznek, hanem darab, tuskó vagy fémtermék formájában. Nézzük meg, mi gyűjti össze a fématomokat egy teljes kötetben.
A példában egy aranydarabot látunk. És mellesleg az arany egyedülálló fém. Kovácsolás segítségével tiszta aranyból 0,002 mm vastag fólia készíthető! Ez a vékony fólialap szinte átlátszó, és fényben zöld árnyalatú. Ennek eredményeként egy gyufásdoboz méretű aranyrúdból egy vékony fóliát kaphat, amely lefedi a teniszpálya területét.
Kémiailag minden fémre jellemző a vegyértékelektronok könnyű feladása, és ennek eredményeként pozitív töltésű ionok képződése és csak pozitív oxidációja van. Ezért a fémek szabad állapotban redukálószerek. A fématomok közös jellemzője a nemfémekhez viszonyított nagy méretük. A külső elektronok nagy távolságra helyezkednek el az atommagtól, ezért gyengén kapcsolódnak hozzá, ezért könnyen elválaszthatók.
A külső szinten nagyobb számú fém atomjainak kis számú elektronja van - 1,2,3. Ezek az elektronok könnyen leválnak, és a fématomok ionokká válnak.
Ме0 – n ē ⇆ Férfi+
fématomok – elektronok kiv. kering ⇆ fémionok
Ily módon a leszakadt elektronok egyik ionról a másikra mozoghatnak, vagyis szabaddá válnak, mintha egyetlen egésszé kapcsolnák össze őket, így kiderül, hogy az összes leszakadt elektron közös, mivel nem lehet megérteni melyik elektron melyik fématomhoz tartozik.
Az elektronok kationokkal egyesülhetnek, ekkor átmenetileg atomok keletkeznek, amelyekből aztán leszakadnak az elektronok. Ez a folyamat folyamatosan és megállás nélkül megy végbe. Kiderült, hogy a fém térfogatában az atomok folyamatosan ionokká alakulnak és fordítva. Ebben az esetben kis számú megosztott elektron nagyszámú fématomot és iont köt meg. De fontos, hogy a fémben lévő elektronok száma egyenlő legyen a pozitív ionok teljes töltésével, vagyis kiderül, hogy általában a fém elektromosan semleges marad.
Ezt a folyamatot modellként mutatják be – a fémionok elektronfelhőben vannak. Az ilyen elektronfelhőt „elektrongáznak” nevezik.
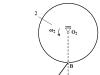
Például ezen a képen azt látjuk, hogyan mozognak az elektronok a mozdulatlan ionok között a fém kristályrácsában. 
Rizs. 2. Elektronmozgás
Annak érdekében, hogy jobban megértsük, mi az elektrongáz, és hogyan viselkedik a különböző fémek kémiai reakcióiban, nézzünk meg egy érdekes videót. (Az arany ebben a videóban csak színként szerepel!)
Most leírhatjuk a definíciót: a fémes kötés a fémekben lévő atomok és ionok közötti kötés, amely elektronok megosztásával jön létre.
Hasonlítsuk össze az általunk ismert kapcsolatok összes típusát, és konszolidáljuk őket a jobb megkülönböztetés érdekében, ehhez meg fogjuk nézni a videót.
A fémes kötés nemcsak tiszta fémekben fordul elő, hanem különböző fémek és ötvözetek különböző halmazállapotú keverékeire is jellemző.
A fémes kötés fontos és meghatározza a fémek alapvető tulajdonságait
- elektromos vezetőképesség – az elektronok véletlenszerű mozgása a fém térfogatában. De kis potenciálkülönbséggel, hogy az elektronok rendezetten mozogjanak. A legjobb vezetőképességű fémek az Ag, Cu, Au, Al.
- plaszticitás
A fémrétegek közötti kötések nem túl jelentősek, ez lehetővé teszi a rétegek terhelés alatti mozgását (deformálja a fémet anélkül, hogy eltörne). A legjobb deformálható fémek (lágyak) az Au, Ag, Cu.
- fémes ragyogás
Az elektrongáz szinte minden fénysugarat visszaveri. Ez az oka annak, hogy a tiszta fémek annyira ragyognak, és legtöbbször szürke vagy fehér színűek. Fémek, amelyek a legjobb reflektorok Ag, Cu, Al, Pd, Hg
Házi feladat
1. Feladat
Válassza ki az anyagok képleteit, amelyek rendelkeznek
a) kovalens poláris kötés: Cl2, KCl, NH3, O2, MgO, CCl4, SO2;
b) ionos kötéssel: HCl, KBr, P4, H2S, Na2O, CO2, CaS.
2. gyakorlat
Húzd át a pluszt:
a) CuCl2, Al, MgS
b) N2, HCl, O2
c) Ca, CO2, Fe
d) MgCl2, NH3, H2
A fémnátrium, a lítium és más alkálifémek megváltoztatják a láng színét. A fémes lítium és sói vörös színt adnak a tűznek, a fémes nátrium és a nátriumsók sárga színt, a fémes kálium és sói lila színt, a rubídium és a cézium pedig lila színt, de világosabbat.
Rizs. 4. Egy darab lítium fém 
Rizs. 5. Lángfestés fémekkel
Lítium (Li). A lítium fém, a nátriumhoz hasonlóan, alkálifém. Mindkettő vízben oldódik. A nátrium vízben oldva nátronlúgot, nagyon erős savat képez. Az alkálifémek vízben való oldásakor sok hő és gáz (hidrogén) szabadul fel. Az ilyen fémeket nem tanácsos kézzel megérinteni, mert megéghet.
Bibliográfia
1. Óra a „Fémes kémiai kötés” témában, kémiatanár Tukhta Valentina Anatoljevna MOU „Jesenovicska Középiskola”
2. F. A. Derkach „Kémia” - tudományos és módszertani kézikönyv. – Kijev, 2008.
3. L. B. Tsvetkova „Szervetlen kémia” - 2. kiadás, javítva és bővítve. – Lvov, 2006.
4. V. V. Malinovsky, P. G. Nagorny „Szervetlen kémia” - Kijev, 2009.
5. Glinka N.L. Általános kémia. – 27. kiad./Alatt. szerk. V.A. Rabinovics. – L.: Kémia, 2008. – 704 p.
Szerkesztette és küldte: Lisnyak A.V.
A leckén dolgozott:
Tukhta V.A.
Lisnyak A.V.
Felvethet egy kérdést a modern oktatással kapcsolatban, megfogalmazhat egy ötletet vagy megoldhat egy sürgető problémát a címen Oktatási fórum, ahol a friss gondolatok és cselekvések oktatási tanácsa találkozik nemzetközi szinten. Miután létrehozta blog, Kémia 8. osztály
Fém csatlakozás
A kation és az anion közötti elektrosztatikus vonzás eredményeként molekula keletkezik.
Ionos kötés
Az ionos kötés elméletét javasolta 1916 ᴦ. W. Kossel német tudós. Ez az elmélet megmagyarázza a közötti kapcsolatok kialakulását tipikus fémek és atomok atomjai tipikus nem fémek: CsF, CsCl, NaCl, KF, KCl, Na 2 O stb.
Ezen elmélet szerint, amikor ionos kötés jön létre, a tipikus fémek atomjai elektronokat adnak fel, a tipikus nemfémek atomjai pedig elektronokat fogadnak el.
Ezen folyamatok eredményeként a fématomok pozitív töltésű részecskékké alakulnak, amelyeket pozitív ionoknak vagy kationoknak neveznek; a nemfém atomok pedig negatív ionokká - anionokká alakulnak. A kation töltése megegyezik a leadott elektronok számával.
A fématomok elektronokat adnak a külső rétegüknek, ill a keletkező ionok teljes elektronszerkezettel rendelkeznek (pre-külső elektronikus réteg).
Az anion negatív töltésének nagysága megegyezik az elfogadott elektronok számával.
A nemfém atomok a számukra rendkívül fontos elektronszámot fogadják el elektronikus oktett kitöltése (külső elektronikus réteg).
Például: NaCl-molekula Na- és C1-atomokból történő képzésének általános sémája: Na°-le = Na +1 Ionok képződése
Сl°+1е - = Сl -
Na +1 + Cl - = Na + Cl -
Na°+ Сl°= Na + Сl - Ionok vegyülete
· Az ionok közötti kötést általában ionos kötésnek nevezik.
Az ionokból álló vegyületeket nevezzük ionos vegyületek.
Az ionos vegyület molekulájában lévő összes ion töltéseinek algebrai összegének nullával kell egyenlőnek lennie, mert bármely molekula elektromosan semleges részecske.
Az ionos és kovalens kötések között nincs éles határ. Az ionos kötés a poláris kovalens kötés extrém esetének tekinthető, amelyben közös elektronpár képződik teljesen nagyobb elektronegativitású atom felé mozog.
A legtöbb tipikus fématomnak kevés elektronja van a külső elektronrétegében (általában 1-3); ezeket az elektronokat vegyértékelektronoknak nevezzük. A fématomokban a vegyértékelektronok és az atommag közötti kötés erőssége kicsi, vagyis az atomok ionizációs energiája alacsony. Ez megkönnyíti a vegyértékelektronok elvesztését h fématomok átalakulása pozitív töltésű ionokká (kationok):
Ме° -ne ® Ме n +
A fém kristályszerkezetében a vegyértékelektronok képesek könnyen átjutni egyik atomról a másikra, ami az elektronok megosztásához vezet az összes szomszédos atom között. Leegyszerűsítve a fémkristály szerkezetét a következőképpen ábrázoljuk: a kristályrács csomópontjaiban Me n+ ionok és Me° atomok találhatók, amelyek között a vegyértékelektronok viszonylag szabadon mozognak, összeköttetést létesítve a kristályrács összes atomja és ionja között. a fémet (3. ábra). Ez egy speciális típusú kémiai kötés, amelyet fémkötésnek neveznek.
· Fémkötés – a kristályrácsban lévő fémek atomjai és ionjai közötti kötés, amelyet megosztott vegyértékelektronok hajtanak végre.
Az ilyen típusú kémiai kötéseknek köszönhetően a fémek bizonyos fizikai és kémiai tulajdonságokkal rendelkeznek, amelyek megkülönböztetik őket a nemfémektől.
 Rizs. 3. Fémek kristályrácsának diagramja.
Rizs. 3. Fémek kristályrácsának diagramja.
A fémkötés szilárdsága biztosítja a kristályrács stabilitását és a fémek plaszticitását (a roncsolás nélküli különféle feldolgozások képességét). A vegyértékelektronok szabad mozgása lehetővé teszi, hogy a fémek jól vezetjék az elektromosságot és a hőt. A fényhullámok visszaverő képességét (ᴛ.ᴇ. fémes csillogás) a fém kristályrácsának szerkezete is magyarázza.
A fémek legjellemzőbb fizikai tulajdonságai azonban a fémes kötés jelenléte alapján a következők:
■ kristályszerkezet;
■ fémes csillogás és átlátszatlanság;
■ plaszticitás, alakíthatóság, olvaszthatóság;
■ magas elektromos és hővezető képesség; és az ötvözetek képződésére való hajlam.
Fémkötés - koncepció és típusok. A "Fém csatlakozás" kategória besorolása és jellemzői 2017, 2018.
Már maga a „fémes kötés” elnevezés is azt jelzi, hogy a fémek belső szerkezetéről beszélünk. A legtöbb fém atomja a külső energiaszinten kevés vegyértékelektront tartalmaz az energetikailag közel álló külsők teljes számához képest... .
A fémes kötés a kristályban nem két, hanem szinte az összes fématomhoz tartozó vegyértékelektronok megosztásán alapul. A fémekben sokkal kevesebb vegyértékelektron található, mint a szabad pályákon. Ez megteremti a szabad mozgás feltételeit... .
A fémek kémiai kötéseinek természetére vonatkozó lényeges információk a kovalens és ionos vegyületekkel összehasonlítva két jellemző tulajdonság alapján nyerhetők. A fémek először is nagy elektromos vezetőképességükben különböznek más anyagoktól és... .
A fémekben lévő kémiai kötések természetéről jelentős információ nyerhető a kovalens és ionos vegyületekkel összehasonlítva két jellemző tulajdonságuk alapján. A fémek először is nagy elektromos vezetőképességükben különböznek más anyagoktól és... .
A pályák hibridizációja és a molekulák térbeli konfigurációja A molekula típusa Az atom kezdeti pályái A hibridizáció típusa Az atom hibrid pályáinak száma A A molekula térbeli konfigurációja AB2 AB3 AB4 s + p s + p + p s + p + p + p sp sp sp2 sp3 ... .
A fémes kötés egy kémiai kötés, amelyet viszonylag szabad elektronok jelenléte okoz. Tiszta fémekre és ötvözeteikre és intermetallikus vegyületekre egyaránt jellemző. A fémes kötés mechanizmusa A kristályrács minden csomópontjában... .
A molekula az anyag legkisebb részecskéje, amelynek kémiai tulajdonságai vannak. A kémiai kötés elmélete szerint egy elem stabil állapota az s2p6 külső szintű elektronképletű szerkezetnek felel meg (argon, kripton, radon és mások). Az oktatás során... .
Az Egységes Államvizsga-kódoló témái: Kovalens kémiai kötés, fajtái és kialakulásának mechanizmusai. A kovalens kötések jellemzői (polaritás és kötési energia). Ionos kötés. Fém csatlakozás. Hidrogén kötés
Intramolekuláris kémiai kötések
Először nézzük meg a molekulákon belüli részecskék között létrejövő kötéseket. Az ilyen kapcsolatokat ún intramolekuláris.
Kémiai kötés kémiai elemek atomjai között elektrosztatikus természetű és miatt jön létre külső (valencia) elektronok kölcsönhatása, kisebb-nagyobb mértékben pozitív töltésű magok tartják kötött atomok.
A kulcsfogalom itt az ELEKTRONEGATIVITÁS. Ez határozza meg az atomok közötti kémiai kötés típusát és ennek a kötésnek a tulajdonságait.
az atom azon képessége, hogy vonzza (tartsa) külső(vegyérték) elektronok. Az elektronegativitást a külső elektronok atommaghoz való vonzódásának mértéke határozza meg, és elsősorban az atom sugarától és az atommag töltésétől függ.
Az elektronegativitást nehéz egyértelműen meghatározni. L. Pauling összeállította a relatív elektronegativitások táblázatát (a kétatomos molekulák kötési energiái alapján). A legelektronegatívabb elem az fluor jelentéssel 4 .
Fontos megjegyezni, hogy a különböző forrásokban különböző skálák és táblázatok találhatók az elektronegativitás értékekről. Ettől nem kell megijedni, hiszen a kémiai kötés kialakulása is szerepet játszik atomok, és ez megközelítőleg azonos minden rendszerben.
Ha az A:B kémiai kötés egyik atomja erősebben vonzza az elektronokat, akkor az elektronpár feléje mozdul. A több elektronegativitás különbség atomok, annál jobban eltolódik az elektronpár.
Ha a kölcsönható atomok elektronegativitása egyenlő vagy megközelítőleg egyenlő: EO(A)≈EO(B), akkor a közös elektronpár nem tolódik el egyik atomra sem: A: B. Ezt a kapcsolatot hívják kovalens nempoláris.
Ha a kölcsönható atomok elektronegativitása eltér, de nem nagy mértékben (az elektronegativitás különbsége körülbelül 0,4 és 2 között van: 0,4<ΔЭО<2 ), akkor az elektronpár az egyik atomra tolódik. Ezt a kapcsolatot hívják kovalens poláris .
Ha a kölcsönható atomok elektronegativitása jelentősen eltér (az elektronegativitás különbsége nagyobb, mint 2: ΔEO>2), akkor az egyik elektron szinte teljesen átkerül egy másik atomra, a keletkezéssel ionok. Ezt a kapcsolatot hívják ión.
A kémiai kötések alaptípusai − kovalens, iónÉs fém kommunikáció. Nézzük meg őket közelebbről.
Kovalens kémiai kötés
Kovalens kötés – ez egy kémiai kötés miatt alakult ki közös elektronpár kialakulása A:B . Ráadásul két atom átfedés atomi pályák. A kovalens kötés kis elektronegativitáskülönbséggel rendelkező atomok kölcsönhatásából jön létre (általában két nemfém között) vagy egy elem atomjai.
A kovalens kötések alapvető tulajdonságai
- fókusz,
- telíthetőség,
- polaritás,
- polarizálhatóság.
Ezek a kötési tulajdonságok befolyásolják az anyagok kémiai és fizikai tulajdonságait.
Kommunikációs irány az anyagok kémiai szerkezetét és formáját jellemzi. A két kötés közötti szögeket kötésszögeknek nevezzük. Például egy vízmolekulában a H-O-H kötésszög 104,45 o, ezért a vízmolekula poláris, a metánmolekulában pedig a H-C-H kötésszög 108 o 28′.

Telíthetőség az atomok azon képessége, hogy korlátozott számú kovalens kémiai kötést hozzanak létre. Az atom által alkotható kötések számát nevezzük.
Polaritás kötés az elektronsűrűség egyenetlen eloszlása miatt következik be két eltérő elektronegativitású atom között. A kovalens kötéseket polárisra és nempolárisra osztják.
Polarizálhatóság kapcsolatok vannak a kötéselektronok eltolódási képessége külső elektromos tér hatására(különösen egy másik részecske elektromos tere). A polarizálhatóság az elektronok mobilitásától függ. Minél távolabb van az elektron az atommagtól, annál mozgékonyabb, és ennek megfelelően a molekula jobban polarizálható.

Kovalens nempoláris kémiai kötés
A kovalens kötésnek 2 típusa van: POLÁRISÉs NEM POLÁRIS .
Példa . Tekintsük a H2 hidrogénmolekula szerkezetét. Minden hidrogénatom a külső energiaszintjén 1 párosítatlan elektront hordoz. Egy atom megjelenítéséhez a Lewis-struktúrát használjuk - ez egy atom külső energiaszintjének szerkezeti diagramja, amikor az elektronokat pontok jelzik. A Lewis-pontszerkezeti modellek nagyon hasznosak a második periódus elemeivel való munka során.
H. + . H = H:H
Így egy hidrogénmolekulának egy közös elektronpárja és egy H-H kémiai kötése van. Ez az elektronpár nem tolódik el egyik hidrogénatomhoz sem, mert A hidrogénatomok elektronegativitása azonos. Ezt a kapcsolatot hívják kovalens nempoláris .

Kovalens nempoláris (szimmetrikus) kötés egy kovalens kötés, amelyet azonos elektronegativitású atomok (általában ugyanazok a nemfémek) alkotnak, és ezért az atommagok között egyenletes elektronsűrűség-eloszlású.
A nem poláris kötések dipólusmomentuma 0.
Példák: H2 (H-H), O 2 (O=O), S 8.
Kovalens poláris kémiai kötés
Kovalens poláris kötés között létrejövő kovalens kötés különböző elektronegativitású atomok (általában, különféle nemfémek) és jellemzi elmozdulás megosztott elektronpárt egy elektronegatívabb atomhoz (polarizáció).
Az elektronsűrűség eltolódik az elektronegatívabb atomra - ezért azon részleges negatív töltés (δ-), a kevésbé elektronegatív atomon pedig részleges pozitív töltés (δ+, delta +) jelenik meg.
Minél nagyobb az atomok elektronegativitásának különbsége, annál nagyobb polaritás kapcsolatok és így tovább dipólmomentum . További vonzó erők hatnak a szomszédos molekulák és az ellenkező előjelű töltések között, ami növekszik erő kommunikáció.
A kötés polaritása befolyásolja a vegyületek fizikai és kémiai tulajdonságait. A reakciómechanizmusok, sőt a szomszédos kötések reakcióképessége is függ a kötés polaritásától. A kapcsolat polaritása gyakran meghatározza molekula polaritásaés így közvetlenül befolyásolja az olyan fizikai tulajdonságokat, mint a forráspont és az olvadáspont, az oldhatóság poláris oldószerekben.
Példák: HCl, CO 2, NH 3.
A kovalens kötés kialakulásának mechanizmusai
A kovalens kémiai kötések 2 mechanizmussal jöhetnek létre:
1. Csere mechanizmus A kovalens kémiai kötés kialakulása az, amikor minden részecske egy párosítatlan elektront biztosít, hogy közös elektronpárt alkosson:
A . + . B= A:B
2. A kovalens kötés kialakulása egy olyan mechanizmus, amelyben az egyik részecske egy magányos elektronpárt, a másik részecske pedig egy üres pályát biztosít ennek az elektronpárnak:
V: + B= A:B

Ebben az esetben az egyik atom egy magányos elektronpárt biztosít ( donor), a másik atom pedig üres pályát biztosít ennek a párnak ( elfogadó). Mindkét kötés kialakulása következtében az elektronok energiája csökken, i.e. ez előnyös az atomok számára.
Donor-akceptor mechanizmussal létrejövő kovalens kötés nem különbözik a cseremechanizmus által létrehozott más kovalens kötések tulajdonságaiban. A kovalens kötés kialakulása a donor-akceptor mechanizmussal jellemző azokra az atomokra, amelyeknél nagyszámú elektron van a külső energiaszinten (elektrondonorok), vagy fordítva, nagyon kis számú elektronnal (elektronakceptorok). Az atomok vegyértékképességét a megfelelő részben tárgyaljuk részletesebben.
A kovalens kötés egy donor-akceptor mechanizmussal jön létre:
- egy molekulában szén-monoxid CO(a molekulában a kötés hármas, 2 kötés cseremechanizmussal, egy donor-akceptor mechanizmussal jön létre): C≡O;
- V ammónium ion NH 4 +, ionokban szerves aminok például a CH3-NH2+ metil-ammóniumionban;
- V összetett vegyületek kémiai kötés a központi atom és a ligandumcsoportok között, például nátrium-tetrahidroxoaluminátban Na-kötés alumínium és hidroxidionok között;
- V salétromsav és sói- nitrátok: HNO 3, NaNO 3, néhány más nitrogénvegyületben;

- egy molekulában ózon O3.
A kovalens kötések alapvető jellemzői
A kovalens kötések jellemzően nemfémes atomok között jönnek létre. A kovalens kötés fő jellemzői a következők hosszúság, energia, sokféleség és irányultság.
A kémiai kötés többszöröse
A kémiai kötés többszöröse - Ezt Egy vegyület két atomja között megosztott elektronpárok száma. A molekulát alkotó atomok értékeiből egy kötés többszörössége meglehetősen könnyen meghatározható.
Például , a H 2 hidrogénmolekulában a kötésmultiplicitás 1, mert Minden hidrogénnek csak 1 párosítatlan elektronja van a külső energiaszintjén, így egy közös elektronpár jön létre.
Az O 2 oxigénmolekulában a kötés többszöröse 2, mert A külső energiaszinten minden atomnak 2 párosítatlan elektronja van: O=O.
Az N2 nitrogénmolekulában a kötési multiplicitás 3, mert minden atom között 3 párosítatlan elektron van a külső energiaszinten, és az atomok 3 közös elektronpárt alkotnak N≡N.
Kovalens kötés hossza
Kémiai kötés hossza
a kötést alkotó atomok magjainak középpontjai közötti távolság. Kísérleti fizikai módszerekkel határozzák meg. A kötés hossza hozzávetőlegesen megbecsülhető az additív szabály segítségével, amely szerint az AB molekulában a kötés hossza megközelítőleg egyenlő az A 2 és B 2 molekulák kötéshosszainak összegének felével: 
A kémiai kötés hossza nagyjából megbecsülhető atomi sugarak szerint kötés kialakítása, ill kommunikációs sokrétűséggel, ha az atomok sugarai nem nagyon különböznek egymástól.
A kötést alkotó atomok sugarának növekedésével a kötés hossza növekszik.
Például
Az atomok közötti kötések sokaságának növekedésével (amelyek atomi sugarai nem, vagy csak kis mértékben térnek el egymástól), a kötés hossza csökken.
Például . A C–C, C=C, C≡C sorozatban a kötés hossza csökken.
Kommunikációs energia
A kémiai kötés erősségének mértéke a kötés energiája. Kommunikációs energia egy kötés megszakításához és a kötést alkotó atomok egymástól végtelen nagy távolságra történő eltávolításához szükséges energia határozza meg.
A kovalens kötés az nagyon tartós. Energiája több tíztől több száz kJ/molig terjed. Minél nagyobb a kötési energia, annál nagyobb a kötés erőssége, és fordítva.
A kémiai kötés erőssége a kötés hosszától, a kötés polaritásától és a kötés többszörösétől függ. Minél hosszabb egy kémiai kötés, annál könnyebben megszakad, és minél alacsonyabb a kötés energiája, annál kisebb az erőssége. Minél rövidebb a kémiai kötés, annál erősebb, és annál nagyobb a kötés energiája.
Például, a HF, HCl, HBr vegyületek sorozatában balról jobbra, a kémiai kötés erőssége csökken, mert A csatlakozás hossza megnő.
Ionos kémiai kötés

Ionos kötés alapú kémiai kötés ionok elektrosztatikus vonzása.
Ionok az elektronok atomok általi befogadása vagy adományozása során keletkeznek. Például az összes fém atomja gyengén tartja az elektronokat a külső energiaszintről. Ezért a fématomokat az jellemzi helyreállító tulajdonságok- elektron adományozási képesség.

Példa. A nátriumatom 1 elektront tartalmaz 3-as energiaszinten. Könnyen feladva a nátriumatom a sokkal stabilabb Na + iont képezi, a Ne nemesgáz neon elektronkonfigurációjával. A nátriumion 11 protont és csak 10 elektront tartalmaz, így az ion teljes töltése -10+11 = +1:
+11Na) 2 ) 8 ) 1 - 1e = +11 Na +) 2 ) 8
Példa. Egy klóratom a külső energiaszintjén 7 elektront tartalmaz. A stabil, inert Argonatom konfigurációjának megszerzéséhez a klórnak 1 elektront kell nyernie. Egy elektron hozzáadása után stabil klórion képződik, amely elektronokból áll. Az ion teljes töltése -1:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Jegyzet:
- Az ionok tulajdonságai eltérnek az atomokétól!
- Stabil ionok nem csak atomok, de szintén atomcsoportok. Például: ammóniumion NH 4 +, szulfátion SO 4 2- stb. Az ilyen ionok által létrehozott kémiai kötéseket is ionosnak tekintjük;
- Általában ionos kötések jönnek létre egymás között fémekÉs nemfémek(nem fémcsoportok);
A keletkező ionok az elektromos vonzás hatására vonzódnak: Na + Cl -, Na 2 + SO 4 2-.
Foglaljuk össze vizuálisan A kovalens és ionos kötéstípusok közötti különbség:


Fém csatlakozás relatíve kialakuló kapcsolat szabad elektronok között fémionok, kristályrácsot képezve.
A fématomok általában a külső energiaszinten helyezkednek el egy-három elektron. A fématomok sugarai általában nagyok - ezért a fématomok, ellentétben a nemfémekkel, meglehetősen könnyen adják fel külső elektronjaikat, pl. erős redukálószerek.
Elektronok adományozásával a fématomok átalakulnak pozitív töltésű ionok . A levált elektronok viszonylag szabadok mozognak pozitív töltésű fémionok között. E részecskék között kapcsolat keletkezik, mert a megosztott elektronok fémkationokat tartanak együtt rétegekben , így egy meglehetősen erős fém kristályrács . Ilyenkor az elektronok folyamatosan kaotikusan mozognak, azaz. Folyamatosan új semleges atomok és új kationok jelennek meg.

Intermolekuláris kölcsönhatások
Külön érdemes figyelembe venni az anyag egyes molekulái között fellépő kölcsönhatásokat - intermolekuláris kölcsönhatások . Az intermolekuláris kölcsönhatások olyan kölcsönhatások semleges atomok között, amelyekben nem jelennek meg új kovalens kötések. A molekulák közötti kölcsönhatás erőit Van der Waals fedezte fel 1869-ben, és róla nevezték el. Van dar Waals erők. Van der Waals erői osztva irányultság, indukció És szétszórt . Az intermolekuláris kölcsönhatások energiája sokkal kisebb, mint a kémiai kötések energiája.
Orientációs vonzási erők poláris molekulák között fordulnak elő (dipól-dipól kölcsönhatás). Ezek az erők a poláris molekulák között lépnek fel. Induktív kölcsönhatások a poláris molekula és a nem poláris molekula közötti kölcsönhatás. Egy nem poláris molekula polarizálódik egy poláris molekula hatására, ami további elektrosztatikus vonzást generál.
Az intermolekuláris kölcsönhatások speciális típusa a hidrogénkötés. - ezek intermolekuláris (vagy intramolekuláris) kémiai kötések, amelyek olyan molekulák között jönnek létre, amelyek erősen poláris kovalens kötésekkel rendelkeznek - H-F, H-O vagy H-N. Ha vannak ilyen kötések egy molekulában, akkor a molekulák között lesznek további vonzó erők .
Oktatási mechanizmus A hidrogénkötés részben elektrosztatikus, részben donor-akceptor. Ebben az esetben az elektronpár donor egy erősen elektronegatív elem (F, O, N) atomja, az akceptor pedig az ezekhez az atomokhoz kapcsolódó hidrogénatomok. A hidrogénkötésekre jellemző fókusz térben és telítettség
A hidrogénkötéseket pontokkal jelölhetjük: H ··· O. Minél nagyobb a hidrogénhez kapcsolódó atom elektronegativitása, és minél kisebb a mérete, annál erősebb a hidrogénkötés. Elsősorban kapcsolatokra jellemző fluor hidrogénnel , valamint ahhoz oxigén és hidrogén , Kevésbé nitrogén hidrogénnel .

Hidrogénkötések jönnek létre a következő anyagok között:
— hidrogén-fluorid HF(gáz, hidrogén-fluorid vizes oldata - fluorsav), víz H 2 O (gőz, jég, folyékony víz):
— ammónia és szerves aminok oldata- az ammónia és a vízmolekulák között;
— szerves vegyületek, amelyekben O-H vagy N-H kötések: alkoholok, karbonsavak, aminok, aminosavak, fenolok, anilin és származékai, fehérjék, szénhidrát oldatok - monoszacharidok és diszacharidok.
A hidrogénkötés befolyásolja az anyagok fizikai és kémiai tulajdonságait. Így a molekulák közötti további vonzás megnehezíti az anyagok forrását. A hidrogénkötéssel rendelkező anyagok forráspontja abnormálisan emelkedik.
Például Általában a molekulatömeg növekedésével az anyagok forráspontjának növekedése figyelhető meg. Számos anyagban azonban H 2 O-H 2 S-H 2 Se-H 2 Te nem figyelünk meg lineáris változást a forráspontokban.

Mégpedig at a víz forráspontja szokatlanul magas - nem kevesebb, mint -61 o C, ahogy az egyenes mutatja, de sokkal több, +100 o C. Ezt az anomáliát a vízmolekulák közötti hidrogénkötések jelenléte magyarázza. Ezért normál körülmények között (0-20 o C) a víz az folyékony fázisállapot szerint.
Fém csatlakozás. A fémes kötés tulajdonságai.
A fémes kötés egy kémiai kötés, amelyet viszonylag szabad elektronok jelenléte okoz. Tiszta fémekre és ötvözeteikre és intermetallikus vegyületekre egyaránt jellemző.
Fém összekötő mechanizmus
A pozitív fémionok a kristályrács minden csomópontjában találhatók. Közöttük a vegyértékelektronok véletlenszerűen mozognak, mint a gázmolekulák, leválva az atomokról az ionok képződése során. Ezek az elektronok cementként működnek, összetartva a pozitív ionokat; különben a rács szétesne az ionok közötti taszító erők hatására. Ugyanakkor az elektronokat ionok tartják a kristályrácson belül, és nem tudnak elhagyni azt. A kapcsolóerők nem lokalizáltak vagy nem irányítottak. Emiatt a legtöbb esetben magas koordinációs számok jelennek meg (például 12 vagy 8). Amikor két fématom közel kerül egymáshoz, a külső héjukban lévő pályák átfedik egymást, és molekuláris pályákat alkotnak. Ha egy harmadik atom közeledik, pályája átfedésben van az első két atom pályájával, ami egy másik molekulapályát eredményez. Ha sok atom van, hatalmas számú háromdimenziós molekulapálya keletkezik, amelyek minden irányban kiterjednek. A többszörös átfedő pályák miatt az egyes atomok vegyértékelektronjait sok atom befolyásolja.
Jellegzetes kristályrácsok
A legtöbb fém a következő erősen szimmetrikus rácsok egyikét alkotja szoros atomtömbbel: testközpontú köbös, arcközpontú köbös és hatszögletű.
Egy testközpontú köbös (bcc) rácsban az atomok a kocka csúcsaiban, egy atom pedig a kockatérfogat közepén helyezkednek el. A fémeknek köbös testközpontú rácsuk van: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba stb.
Egy lapközpontú kocka (fcc) rácsban az atomok a kocka csúcsaiban és az egyes lapok közepén helyezkednek el. Az ilyen típusú fémek rácsosak: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co stb.
A hatszögletű rácsban az atomok a prizma hatszögletű alapjainak csúcsaiban és középpontjában, három atom pedig a prizma középső síkjában található. A fémek ilyen atomcsomaggal rendelkeznek: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca stb.
Egyéb tulajdonságok
A szabadon mozgó elektronok magas elektromos és hővezető képességet okoznak. A fémes kötéssel rendelkező anyagok gyakran egyesítik az erőt a plaszticitással, mivel amikor az atomok egymáshoz képest elmozdulnak, a kötések nem szakadnak meg. Egy másik fontos tulajdonság a fémes aromás.
A fémek jól vezetik a hőt és az elektromosságot, elég erősek, roncsolódás nélkül deformálódhatnak. Egyes fémek képlékenyek (kovácsolhatók), vannak, amelyek képlékenyek (huzalt lehet belőlük húzni). Ezeket az egyedi tulajdonságokat egy speciális kémiai kötés magyarázza, amely összeköti a fématomokat egymással - egy fémes kötés.
A szilárd állapotban lévő fémek pozitív ionok kristályai formájában léteznek, mintha „lebegnének” a közöttük szabadon mozgó elektrontengerben.
A fémes kötés megmagyarázza a fémek tulajdonságait, különösen azok szilárdságát. A deformáló erő hatására a fémrács repedés nélkül képes megváltoztatni alakját, ellentétben az ionos kristályokkal.
A fémek nagy hővezető képessége azzal magyarázható, hogy ha egy fémdarabot az egyik oldalon felmelegítenek, az elektronok mozgási energiája megnő. Ez az energianövekedés nagy sebességgel terjed majd az „elektrontengerben” a mintában.
A fémek elektromos vezetőképessége is világossá válik. Ha egy fémminta végein potenciálkülönbséget alkalmazunk, a delokalizált elektronok felhője a pozitív potenciál irányába tolódik el: ez az egy irányban mozgó elektronáramlás az ismerős elektromos áramot képviseli.
Fém csatlakozás. A fémes kötés tulajdonságai. - koncepció és típusok. A "Fémes kötés. A fémes kötés tulajdonságai" kategória besorolása és jellemzői. 2017, 2018.