Ligação iônica
(foram utilizados materiais do site http://www.hemi.nsu.ru/ucheb138.htm)
A ligação iônica ocorre através da atração eletrostática entre íons com carga oposta. Esses íons são formados como resultado da transferência de elétrons de um átomo para outro. Uma ligação iônica é formada entre átomos que apresentam grandes diferenças de eletronegatividade (geralmente maiores que 1,7 na escala de Pauling), por exemplo, entre átomos de metais alcalinos e halogênios.
Consideremos a ocorrência de uma ligação iônica usando o exemplo da formação de NaCl.
Das fórmulas eletrônicas dos átomos
Na 1s 2 2s 2 2p 6 3s 1 e
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Pode-se observar que para completar o nível externo é mais fácil para um átomo de sódio ceder um elétron do que ganhar sete, e para um átomo de cloro é mais fácil ganhar um elétron do que ganhar sete. Nas reações químicas, o átomo de sódio cede um elétron e o átomo de cloro o recebe. Como resultado, as camadas eletrônicas dos átomos de sódio e cloro são transformadas em camadas eletrônicas estáveis de gases nobres (configuração eletrônica do cátion sódio
Na + 1s 2 2s 2 2p 6,
e a configuração eletrônica do ânion cloro é
Cl – - 1s 2 2s 2 2p 6 3s 2 3p 6).
A interação eletrostática de íons leva à formação de uma molécula de NaCl.
A natureza da ligação química é frequentemente refletida no estado de agregação e nas propriedades físicas da substância. Compostos iônicos como o cloreto de sódio NaCl são duros e refratários porque existem poderosas forças de atração eletrostática entre as cargas de seus íons “+” e “-”.
O íon cloro carregado negativamente atrai não apenas “seu” íon Na+, mas também outros íons sódio ao seu redor. Isso leva ao fato de que perto de qualquer um dos íons não existe um íon com sinal oposto, mas vários.
A estrutura de um cristal de cloreto de sódio NaCl.
Na verdade, existem 6 íons de sódio ao redor de cada íon de cloro e 6 íons de cloro ao redor de cada íon de sódio. Este empacotamento ordenado de íons é chamado de cristal iônico. Se um único átomo de cloro for isolado em um cristal, então entre os átomos de sódio que o rodeiam não será mais possível encontrar aquele com o qual o cloro reagiu.
Atraídos uns pelos outros por forças eletrostáticas, os íons são extremamente relutantes em mudar sua localização sob a influência de forças externas ou de um aumento de temperatura. Mas se o cloreto de sódio for derretido e continuar a ser aquecido no vácuo, ele evapora, formando moléculas diatômicas de NaCl. Isto sugere que as forças de ligação covalente nunca são completamente desligadas.
Características básicas das ligações iônicas e propriedades dos compostos iônicos
1. Uma ligação iônica é uma ligação química forte. A energia desta ligação é da ordem de 300 – 700 kJ/mol.
2. Ao contrário de uma ligação covalente, uma ligação iônica é não direcional porque um íon pode atrair íons de sinal oposto para si mesmo em qualquer direção.
3. Ao contrário de uma ligação covalente, uma ligação iônica é insaturada, uma vez que a interação de íons de sinal oposto não leva à compensação mútua completa de seus campos de força.
4. Durante a formação de moléculas com ligação iônica, não ocorre transferência completa de elétrons, portanto, ligações iônicas de cem por cento não existem na natureza. Na molécula de NaCl, a ligação química é apenas 80% iônica.
5. Compostos com ligações iônicas são sólidos cristalinos que possuem altos pontos de fusão e ebulição.
6. A maioria dos compostos iônicos são solúveis em água. Soluções e fundidos de compostos iônicos conduzem corrente elétrica.
Conexão metálica
Os cristais de metal são estruturados de maneira diferente. Se você examinar um pedaço de sódio metálico, descobrirá que sua aparência é muito diferente do sal de cozinha. O sódio é um metal macio, facilmente cortado com faca, achatado com martelo, pode ser facilmente derretido em um copo em uma lamparina a álcool (ponto de fusão 97,8 o C). Num cristal de sódio, cada átomo está rodeado por outros oito átomos semelhantes.

Estrutura cristalina do Na metálico.
A figura mostra que o átomo de Na no centro do cubo tem 8 vizinhos mais próximos. Mas o mesmo pode ser dito de qualquer outro átomo de um cristal, uma vez que são todos iguais. O cristal consiste em fragmentos repetidos "infinitamente" mostrados nesta figura.
Os átomos de metal no nível de energia externo contêm um pequeno número de elétrons de valência. Como a energia de ionização dos átomos metálicos é baixa, os elétrons de valência são fracamente retidos nesses átomos. Como resultado, íons carregados positivamente e elétrons livres aparecem na estrutura cristalina dos metais. Nesse caso, os cátions metálicos estão localizados nos nós da rede cristalina, e os elétrons se movem livremente no campo dos centros positivos, formando o chamado “gás de elétrons”.
A presença de um elétron carregado negativamente entre dois cátions faz com que cada cátion interaja com esse elétron.
Por isso, A ligação metálica é a ligação entre íons positivos em cristais metálicos que ocorre através da atração de elétrons que se movem livremente por todo o cristal.
Como os elétrons de valência em um metal estão distribuídos uniformemente por todo o cristal, uma ligação metálica, como uma ligação iônica, é uma ligação não direcional. Ao contrário de uma ligação covalente, uma ligação metálica é uma ligação insaturada. Uma ligação metálica também difere de uma ligação covalente em força. A energia de uma ligação metálica é aproximadamente três a quatro vezes menor que a energia de uma ligação covalente.
Devido à alta mobilidade do gás eletrônico, os metais são caracterizados por alta condutividade elétrica e térmica.
O cristal metálico parece bastante simples, mas na verdade sua estrutura eletrônica é mais complexa que a dos cristais de sal iônico. Não há elétrons suficientes na camada externa de elétrons dos elementos metálicos para formar uma ligação covalente ou iônica de “octeto” completa. Portanto, no estado gasoso, a maioria dos metais consiste em moléculas monoatômicas (ou seja, átomos individuais não conectados entre si). Um exemplo típico é o vapor de mercúrio. Assim, a ligação metálica entre os átomos metálicos ocorre apenas no estado de agregação líquido e sólido.
Uma ligação metálica pode ser descrita da seguinte forma: alguns dos átomos de metal no cristal resultante cedem seus elétrons de valência para o espaço entre os átomos (para o sódio é...3s1), transformando-se em íons. Como todos os átomos de metal em um cristal são iguais, cada um tem chances iguais de perder um elétron de valência.
Em outras palavras, a transferência de elétrons entre átomos metálicos neutros e ionizados ocorre sem consumo de energia. Nesse caso, alguns elétrons sempre acabam no espaço entre os átomos na forma de “gás de elétrons”.
Esses elétrons livres, em primeiro lugar, mantêm os átomos metálicos a uma certa distância de equilíbrio um do outro.
Em segundo lugar, eles conferem aos metais um “brilho metálico” característico (elétrons livres podem interagir com quanta de luz).
Em terceiro lugar, os elétrons livres fornecem aos metais boa condutividade elétrica. A alta condutividade térmica dos metais também é explicada pela presença de elétrons livres no espaço interatômico - eles “respondem” facilmente às mudanças de energia e contribuem para sua rápida transferência no cristal.

Um modelo simplificado da estrutura eletrônica de um cristal metálico.
******** Usando o metal sódio como exemplo, consideremos a natureza da ligação metálica do ponto de vista das ideias sobre orbitais atômicos. O átomo de sódio, como muitos outros metais, carece de elétrons de valência, mas existem orbitais de valência livres. O único elétron 3s do sódio é capaz de se mover para qualquer um dos orbitais vizinhos livres e de energia próxima. À medida que os átomos de um cristal se aproximam, os orbitais externos dos átomos vizinhos se sobrepõem, permitindo que os elétrons cedidos se movam livremente por todo o cristal.
Contudo, o “gás eletrônico” não é tão desordenado quanto pode parecer. Os elétrons livres em um cristal metálico estão em orbitais sobrepostos e são, até certo ponto, compartilhados, formando algo como ligações covalentes. Sódio, potássio, rubídio e outros elementos metálicos simplesmente têm poucos elétrons compartilhados, então seus cristais são frágeis e fusíveis. À medida que o número de elétrons de valência aumenta, a resistência dos metais geralmente aumenta.
Assim, as ligações metálicas tendem a ser formadas por elementos cujos átomos possuem poucos elétrons de valência em suas camadas externas. Esses elétrons de valência, que realizam a ligação metálica, são tão compartilhados que podem se mover por todo o cristal metálico e proporcionar alta condutividade elétrica do metal.
Um cristal de NaCl não conduz eletricidade porque não há elétrons livres no espaço entre os íons. Todos os elétrons doados pelos átomos de sódio são firmemente retidos pelos íons cloro. Esta é uma das diferenças significativas entre os cristais iônicos e os metálicos.
O que você sabe agora sobre ligações metálicas ajuda a explicar a alta maleabilidade (ductilidade) da maioria dos metais. O metal pode ser achatado em uma folha fina e transformado em arame. O fato é que camadas individuais de átomos em um cristal metálico podem deslizar umas sobre as outras com relativa facilidade: o “gás eletrônico” móvel suaviza constantemente o movimento de íons positivos individuais, protegendo-os uns dos outros.
É claro que nada disso pode ser feito com o sal de cozinha, embora o sal também seja uma substância cristalina. Nos cristais iônicos, os elétrons de valência estão fortemente ligados ao núcleo do átomo. O deslocamento de uma camada de íons em relação a outra aproxima íons da mesma carga e causa forte repulsão entre eles, resultando na destruição do cristal (o NaCl é uma substância frágil).

A mudança das camadas de um cristal iônico causa o aparecimento de grandes forças repulsivas entre íons semelhantes e a destruição do cristal.
Navegação
- Resolvendo problemas combinados com base nas características quantitativas de uma substância
- Solução de problemas. A lei da constância da composição das substâncias. Cálculos utilizando os conceitos de “massa molar” e “quantidade química” de uma substância
O objetivo da lição
- Dê uma ideia da ligação química do metal.
- Aprenda a anotar padrões de formação de ligações metálicas.
- Familiarize-se com as propriedades físicas dos metais.
- Aprenda a distinguir claramente entre as espécies ligações químicas .
lições objetivas
- Descubra como eles interagem entre si átomos metálicos
- Determine como uma ligação metálica afeta as propriedades das substâncias por ela formadas
Termos chave:
- Eletro-negatividade - uma propriedade química de um átomo, que é uma característica quantitativa da capacidade de um átomo em uma molécula de atrair pares de elétrons comuns.
- Ligação química -o fenômeno da interação dos átomos, devido à sobreposição de nuvens eletrônicas de átomos em interação.
- Conexão metálica é uma ligação em metais entre átomos e íons, formada através do compartilhamento de elétrons.
- Ligação covalente - uma ligação química formada pela sobreposição de um par de elétrons de valência. Os elétrons que fornecem a conexão são chamados de par de elétrons comum. Existem 2 tipos: polares e apolares.
- Ligação iônica - uma ligação química que se forma entre átomos não metálicos, na qual um par de elétrons compartilhado vai para um átomo com maior eletronegatividade. Como resultado, os átomos atraem corpos com cargas opostas.
- Ligação de hidrogênio
- uma ligação química entre um átomo eletronegativo e um átomo de hidrogênio H ligado covalentemente a outro átomo eletronegativo. Os átomos eletronegativos podem ser N, O ou F. As ligações de hidrogênio podem ser intermoleculares ou intramoleculares.
DURANTE AS AULAS
Ligação química metálica
Identifique os elementos que estão na “fila” errada. Porquê?
Ca Fe P K Al Mg Na
Quais elementos da tabela Mendeleev são chamados de metais?
Hoje aprenderemos quais propriedades os metais possuem e como elas dependem da ligação que se forma entre os íons metálicos.
Primeiro, vamos lembrar a localização dos metais na tabela periódica?
Os metais, como todos sabemos, geralmente não existem na forma de átomos isolados, mas na forma de peça, lingote ou produto metálico. Vamos descobrir o que reúne os átomos de metal em um volume completo.
No exemplo vemos uma peça de ouro. E por falar nisso, o ouro é um metal único. Usando forjamento, ouro puro pode ser usado para fazer folhas com 0,002 mm de espessura! Esta fina folha de papel alumínio é quase transparente e tem uma tonalidade verde à luz. Como resultado, a partir de um lingote de ouro do tamanho de uma caixa de fósforos, você pode obter uma folha fina que cobrirá a área de uma quadra de tênis.
Quimicamente, todos os metais são caracterizados pela facilidade de ceder elétrons de valência e, como resultado, pela formação de íons carregados positivamente e apresentam apenas oxidação positiva. É por isso que os metais em estado livre são agentes redutores. Uma característica comum dos átomos metálicos é seu grande tamanho em relação aos não metais. Os elétrons externos estão localizados a grandes distâncias do núcleo e, portanto, estão fracamente conectados a ele, portanto são facilmente separados.
Átomos de um maior número de metais no nível externo possuem um pequeno número de elétrons - 1,2,3. Esses elétrons são facilmente removidos e os átomos metálicos tornam-se íons.
Ме0 – n ē ⇆ Homens+
átomos de metal – elétrons ext. órbitas ⇆ íons metálicos
Dessa forma, os elétrons destacados podem passar de um íon para outro, ou seja, ficam livres, como se os ligassem em um único todo. Portanto, verifica-se que todos os elétrons destacados são comuns, pois é impossível entender qual elétron pertence a qual dos átomos do metal.
Os elétrons podem se combinar com cátions, então os átomos são formados temporariamente, dos quais os elétrons são então arrancados. Este processo ocorre constantemente e sem parar. Acontece que no volume do metal os átomos são continuamente transformados em íons e vice-versa. Neste caso, um pequeno número de elétrons compartilhados liga um grande número de átomos e íons metálicos. Mas é importante que o número de elétrons no metal seja igual à carga total dos íons positivos, ou seja, verifica-se que em geral o metal permanece eletricamente neutro.
Este processo é apresentado como um modelo - os íons metálicos estão em uma nuvem de elétrons. Essa nuvem de elétrons é chamada de “gás de elétrons”.
Por exemplo, nesta imagem vemos como os elétrons se movem entre os íons imóveis dentro da rede cristalina do metal. 
Arroz. 2. Movimento de elétrons
Para entender melhor o que é o gás elétron e como ele se comporta nas reações químicas de diferentes metais, vamos assistir a um vídeo interessante. (o ouro é mencionado apenas como cor neste vídeo!)
Agora podemos escrever a definição: uma ligação metálica é uma ligação em metais entre átomos e íons, formada pelo compartilhamento de elétrons.
Vamos comparar todos os tipos de conexões que conhecemos e consolidá-las para melhor distingui-las, para isso assistiremos ao vídeo.
A ligação metálica ocorre não apenas em metais puros, mas também é característica de misturas de diferentes metais e ligas em diferentes estados de agregação.
A ligação metálica é importante e determina as propriedades básicas dos metais
- condutividade elétrica – movimento aleatório de elétrons no volume do metal. Mas com uma pequena diferença de potencial, para que os elétrons se movam de forma ordenada. Os metais com melhor condutividade são Ag, Cu, Au, Al.
- plasticidade
As ligações entre as camadas metálicas não são muito significativas, o que permite que as camadas se movam sob carga (deformam o metal sem quebrá-lo). Os melhores metais deformáveis (macios) são Au, Ag, Cu.
- brilho metálico
O gás eletrônico reflete quase todos os raios de luz. É por isso que os metais puros brilham tanto e na maioria das vezes apresentam uma cor cinza ou branca. Metais que são os melhores refletores Ag, Cu, Al, Pd, Hg
Trabalho de casa
Exercício 1
Escolha as fórmulas das substâncias que possuem
a) ligação polar covalente: Cl2, KCl, NH3, O2, MgO, CCl4, SO2;
b) com ligação iônica: HCl, KBr, P4, H2S, Na2O, CO2, CaS.
Exercício 2
Risque o extra:
a) CuCl2, Al, MgS
b) N2, HCl, O2
c) Ca, CO2, Fe
d) MgCl2, NH3, H2
O sódio metálico, o lítio metálico e outros metais alcalinos mudam a cor da chama. O lítio metálico e seus sais conferem ao fogo uma cor vermelha, o sódio metálico e os sais de sódio conferem-lhe uma cor amarela, o potássio metálico e seus sais conferem-lhe uma cor roxa, e o rubídio e o césio conferem-lhe uma cor roxa, mas mais clara.
Arroz. 4. Um pedaço de metal de lítio 
Arroz. 5. Coloração de chama com metais
Lítio (Li). O metal de lítio, assim como o metal de sódio, é um metal alcalino. Ambos são solúveis em água. O sódio, quando dissolvido em água, forma soda cáustica, um ácido muito forte. Quando os metais alcalinos são dissolvidos em água, muito calor e gás (hidrogênio) são liberados. É aconselhável não tocar nesses metais com as mãos, pois você pode se queimar.
Bibliografia
1. Aula sobre o tema “Ligação química metálica”, professora de química Tukhta Valentina Anatolyevna MOU "Escola Secundária Yesenovichskaya"
2. F. A. Derkach “Química” - manual científico e metodológico. – Kyiv, 2008.
3. L. B. Tsvetkova “Química Inorgânica” - 2ª edição, corrigida e ampliada. – Lvov, 2006.
4. VV Malinovsky, PG Nagorny “Química Inorgânica” - Kiev, 2009.
5. Glinka N.L. Química Geral. – 27ª ed./Abaixo. Ed. V.A. Rabinovich. – L.: Química, 2008. – 704 pp.
Editado e enviado por Lisnyak A.V.
Trabalhou na lição:
Tukhta V.A.
Lisnyak A.V.
Você pode levantar uma questão sobre a educação moderna, expressar uma ideia ou resolver um problema urgente em Fórum educacional, onde um conselho educacional de pensamento e ação inovadores se reúne internacionalmente. Tendo criado blog, Química 8º ano
Conexão metálica
Como resultado da atração eletrostática entre o cátion e o ânion, uma molécula é formada.
Ligação iônica
A teoria da ligação iônica foi proposta por 1916 ᴦ. Cientista alemão W. Kossel. Esta teoria explica a formação de conexões entre átomos de metais e átomos típicos típica não metais: CsF, CsCl, NaCl, KF, KCl, Na2O, etc.
De acordo com esta teoria, quando uma ligação iônica é formada, os átomos de metais típicos doam elétrons e os átomos de não metais típicos aceitam elétrons.
Como resultado desses processos, os átomos metálicos são transformados em partículas carregadas positivamente, que são chamadas de íons ou cátions positivos; e os átomos não metálicos se transformam em íons negativos - ânions. A carga do cátion é igual ao número de elétrons cedidos.
Os átomos de metal doam elétrons para sua camada externa e os íons resultantes têm estruturas eletrônicas completas (camada eletrônica pré-externa).
A magnitude da carga negativa do ânion é igual ao número de elétrons aceitos.
Os átomos não metálicos aceitam o número de elétrons que é extremamente importante para eles conclusão de um octeto eletrônico (camada eletrônica externa).
Por exemplo: o esquema geral para a formação de uma molécula de NaCl a partir dos átomos de Na e C1: Na°-le = Na +1 Formação de íons
Сl°+1е - = Сl -
Na +1 + Cl - = Na + Cl -
Na°+ Сl°= Na + Сl - Composto de íons
· A ligação entre os íons é comumente chamada de ligação iônica.
Os compostos que consistem em íons são chamados compostos iónicos.
A soma algébrica das cargas de todos os íons na molécula de um composto iônico deve ser igual a zero, porque qualquer molécula é uma partícula eletricamente neutra.
Não existe uma fronteira nítida entre ligações iônicas e covalentes. Uma ligação iônica pode ser considerada um caso extremo de ligação covalente polar, em que a formação de um par de elétrons compartilhado completamente move-se em direção ao átomo com maior eletronegatividade.
A maioria dos átomos metálicos típicos tem um pequeno número de elétrons em sua camada externa de elétrons (normalmente 1 a 3); esses elétrons são chamados elétrons de valência. Nos átomos metálicos, a força da ligação entre os elétrons de valência e o núcleo é baixa, ou seja, os átomos possuem baixa energia de ionização. Isso facilita a perda de elétrons de valência h transformação de átomos metálicos em íons carregados positivamente (cátions):
Ме° -ne ® Ме n +
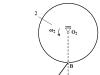
Na estrutura cristalina de um metal, os elétrons de valência têm a capacidade de se mover facilmente de um átomo para outro, o que leva ao compartilhamento de elétrons por todos os átomos vizinhos. De forma simplificada, a estrutura de um cristal metálico é representada da seguinte forma: nos nós da rede cristalina existem íons Me n+ e átomos Me°, e os elétrons de valência se movem relativamente livremente entre eles, estabelecendo conexões entre todos os átomos e íons de o metal (Fig. 3). Este é um tipo especial de ligação química chamada ligação metálica.
· Ligação metálica - ligação entre átomos e íons de metais em uma rede cristalina, realizada por elétrons de valência compartilhados.
Graças a este tipo de ligação química, os metais possuem um determinado conjunto de propriedades físicas e químicas que os distinguem dos não metais.
 Arroz. 3. Diagrama da rede cristalina dos metais.
Arroz. 3. Diagrama da rede cristalina dos metais.
A força da ligação metálica garante a estabilidade da rede cristalina e a plasticidade dos metais (a capacidade de sofrer vários processamentos sem destruição). O livre movimento dos elétrons de valência permite que os metais conduzam bem eletricidade e calor. A capacidade de refletir ondas de luz (ᴛ.ᴇ. brilho metálico) também é explicada pela estrutura da rede cristalina do metal.
Contudo, as propriedades físicas mais características dos metais com base na presença de uma ligação metálica são:
■estrutura cristalina;
■brilho metálico e opacidade;
■plasticidade, maleabilidade, fusibilidade;
■alta condutividade elétrica e térmica; e uma tendência para formar ligas.
Ligação metálica - conceito e tipos. Classificação e características da categoria “Conexão metálica” 2017, 2018.
O próprio nome “ligação metálica” indica que estamos falando da estrutura interna dos metais. Os átomos da maioria dos metais no nível de energia externo contêm um pequeno número de elétrons de valência em comparação com o número total de elétrons externos que estão energeticamente próximos... .
A ligação metálica é baseada no compartilhamento de elétrons de valência pertencentes não a dois, mas a quase todos os átomos metálicos do cristal. Nos metais, há muito menos elétrons de valência do que orbitais livres. Isso cria condições para a livre circulação... .
Informações essenciais sobre a natureza das ligações químicas em metais podem ser obtidas com base em duas características em comparação com compostos covalentes e iônicos. Os metais, em primeiro lugar, diferem de outras substâncias pela sua alta condutividade elétrica e... .
Informações significativas sobre a natureza das ligações químicas em metais podem ser obtidas com base em duas características deles em comparação com compostos covalentes e iônicos. Os metais, em primeiro lugar, diferem de outras substâncias pela sua alta condutividade elétrica e... .
Hibridização de orbitais e configuração espacial das moléculas Tipo de molécula Orbitais iniciais do átomo A Tipo de hibridização Número de orbitais híbridos do átomo A Configuração espacial da molécula AB2 AB3 AB4 s + p s + p + p s + p + p + p sp sp sp2 sp3 ....
Uma ligação metálica é uma ligação química causada pela presença de elétrons relativamente livres. Característica tanto de metais puros quanto de suas ligas e compostos intermetálicos. Mecanismo de ligação metálica Em todos os nós da rede cristalina existem... .
Uma molécula é a menor partícula de uma substância que possui suas propriedades químicas. De acordo com a teoria da ligação química, o estado estável de um elemento corresponde a uma estrutura com a fórmula eletrônica do nível externo s2p6 (argônio, criptônio, radônio e outros). Durante a educação... .
Tópicos do codificador do Exame de Estado Unificado: Ligação química covalente, suas variedades e mecanismos de formação. Características das ligações covalentes (polaridade e energia de ligação). Ligação iônica. Conexão metálica. Ligação de hidrogênio
Ligações químicas intramoleculares
Primeiro, vejamos as ligações que surgem entre as partículas dentro das moléculas. Tais conexões são chamadas intramolecular.
Ligação química entre átomos de elementos químicos tem natureza eletrostática e é formada devido a interação de elétrons externos (valência), em maior ou menor grau mantido por núcleos carregados positivamenteátomos ligados.
O conceito chave aqui é ELETRO-NEGATIVIDADE. É isso que determina o tipo de ligação química entre os átomos e as propriedades dessa ligação.
é a capacidade de um átomo de atrair (manter) externo(valência) elétrons. A eletronegatividade é determinada pelo grau de atração dos elétrons externos ao núcleo e depende principalmente do raio do átomo e da carga do núcleo.
A eletronegatividade é difícil de determinar inequivocamente. L. Pauling compilou uma tabela de eletronegatividades relativas (com base nas energias de ligação das moléculas diatômicas). O elemento mais eletronegativo é flúor com significado 4 .
É importante notar que em diferentes fontes você pode encontrar diferentes escalas e tabelas de valores de eletronegatividade. Isto não deve ser alarmante, uma vez que a formação de uma ligação química desempenha um papel átomos, e é aproximadamente o mesmo em qualquer sistema.
Se um dos átomos da ligação química A:B atrair elétrons com mais força, o par de elétrons se moverá em sua direção. O mais diferença de eletronegatividadeátomos, mais o par de elétrons se desloca.
Se as eletronegatividades dos átomos em interação forem iguais ou aproximadamente iguais: EO(A)≈EO(B), então o par de elétrons comum não muda para nenhum dos átomos: R: B. Essa conexão é chamada covalente apolar.
Se as eletronegatividades dos átomos em interação diferem, mas não muito (a diferença na eletronegatividade é de aproximadamente 0,4 a 2: 0,4<ΔЭО<2 ), então o par de elétrons é deslocado para um dos átomos. Essa conexão é chamada polar covalente .
Se as eletronegatividades dos átomos em interação diferirem significativamente (a diferença na eletronegatividade for maior que 2: ΔEO>2), então um dos elétrons é quase completamente transferido para outro átomo, com a formação íons. Essa conexão é chamada iônico.
Tipos básicos de ligações químicas - covalente, iônico E metal comunicações. Vamos dar uma olhada neles.
Ligação química covalente
Ligação covalente – é uma ligação química , formado devido a formação de um par de elétrons comum A:B . Além disso, dois átomos sobreposição orbitais atômicos. Uma ligação covalente é formada pela interação de átomos com uma pequena diferença na eletronegatividade (geralmente entre dois não metais) ou átomos de um elemento.
Propriedades básicas de ligações covalentes
- foco,
- saturabilidade,
- polaridade,
- polarizabilidade.
Estas propriedades de ligação influenciam as propriedades químicas e físicas das substâncias.
Direção de comunicação caracteriza a estrutura química e a forma das substâncias. Os ângulos entre duas ligações são chamados de ângulos de ligação. Por exemplo, numa molécula de água o ângulo de ligação H-O-H é 104,45 o, portanto a molécula de água é polar, e numa molécula de metano o ângulo de ligação H-C-H é 108 o 28′.

Saturabilidade é a capacidade dos átomos de formar um número limitado de ligações químicas covalentes. O número de ligações que um átomo pode formar é chamado.
Polaridade a ligação ocorre devido à distribuição desigual da densidade eletrônica entre dois átomos com eletronegatividade diferente. As ligações covalentes são divididas em polares e apolares.
Polarizabilidade conexões são a capacidade dos elétrons de ligação se deslocarem sob a influência de um campo elétrico externo(em particular, o campo elétrico de outra partícula). A polarizabilidade depende da mobilidade dos elétrons. Quanto mais longe o elétron estiver do núcleo, mais móvel ele será e, conseqüentemente, a molécula será mais polarizável.

Ligação química covalente apolar
Existem 2 tipos de ligação covalente – POLAR E NÃO POLAR .
Exemplo . Consideremos a estrutura da molécula de hidrogênio H2. Cada átomo de hidrogênio em seu nível de energia externo carrega 1 elétron desemparelhado. Para representar um átomo, usamos a estrutura de Lewis - este é um diagrama da estrutura do nível de energia externo de um átomo, quando os elétrons são indicados por pontos. Os modelos de estrutura de pontos de Lewis são bastante úteis ao trabalhar com elementos do segundo período.
H. + . H = H: H
Assim, uma molécula de hidrogênio tem um par de elétrons compartilhado e uma ligação química H – H. Este par de elétrons não se desloca para nenhum dos átomos de hidrogênio, porque Os átomos de hidrogênio têm a mesma eletronegatividade. Essa conexão é chamada covalente não polar .

Ligação covalente não polar (simétrica) é uma ligação covalente formada por átomos com igual eletronegatividade (geralmente os mesmos não metais) e, portanto, com distribuição uniforme de densidade eletrônica entre os núcleos dos átomos.
O momento de dipolo das ligações apolares é 0.
Exemplos: H 2 (H-H), O 2 (O=O), S 8.
Ligação química polar covalente
Ligação polar covalente é uma ligação covalente que ocorre entre átomos com eletronegatividade diferente (geralmente, vários não metais) e é caracterizado deslocamento par de elétrons compartilhado com um átomo mais eletronegativo (polarização).
A densidade do elétron é deslocada para o átomo mais eletronegativo - portanto, uma carga parcial negativa (δ-) aparece nele e uma carga parcial positiva (δ+, delta +) aparece no átomo menos eletronegativo.
Quanto maior a diferença na eletronegatividade dos átomos, maior polaridade conexões e muito mais momento dipolar . Forças atrativas adicionais atuam entre moléculas vizinhas e cargas de sinais opostos, o que aumenta força comunicações.
A polaridade da ligação afeta as propriedades físicas e químicas dos compostos. Os mecanismos de reação e até mesmo a reatividade das ligações vizinhas dependem da polaridade da ligação. A polaridade da conexão geralmente determina polaridade da molécula e, portanto, afeta diretamente propriedades físicas como ponto de ebulição e ponto de fusão, solubilidade em solventes polares.
Exemplos: HCl, CO 2, NH 3.
Mecanismos de formação de ligação covalente
As ligações químicas covalentes podem ocorrer por 2 mecanismos:
1. Mecanismo de troca a formação de uma ligação química covalente ocorre quando cada partícula fornece um elétron desemparelhado para formar um par de elétrons comum:
A . + . B= UMA:B
2. A formação de ligação covalente é um mecanismo no qual uma das partículas fornece um par solitário de elétrons e a outra partícula fornece um orbital vago para este par de elétrons:
A: + B= UMA:B

Neste caso, um dos átomos fornece um par solitário de elétrons ( doador), e o outro átomo fornece um orbital vago para esse par ( aceitante). Como resultado da formação de ambas as ligações, a energia dos elétrons diminui, ou seja, isso é benéfico para os átomos.
Uma ligação covalente formada por um mecanismo doador-aceitador não é diferente nas propriedades de outras ligações covalentes formadas pelo mecanismo de troca. A formação de uma ligação covalente pelo mecanismo doador-aceitador é típica para átomos com um grande número de elétrons no nível de energia externo (doadores de elétrons) ou, inversamente, com um número muito pequeno de elétrons (aceitadores de elétrons). As capacidades de valência dos átomos são discutidas com mais detalhes na seção correspondente.
Uma ligação covalente é formada por um mecanismo doador-aceitador:
- em uma molécula monóxido de carbono CO(a ligação na molécula é tripla, 2 ligações são formadas pelo mecanismo de troca, uma pelo mecanismo doador-aceitador): C≡O;
-V íon amônio NH 4 +, em íons aminas orgânicas, por exemplo, no íon metilamônio CH 3 -NH 2 + ;
-V compostos complexos, uma ligação química entre o átomo central e os grupos ligantes, por exemplo, na ligação Na de tetrahidroxoaluminato de sódio entre íons alumínio e hidróxido;
-V ácido nítrico e seus sais- nitratos: HNO 3, NaNO 3, em alguns outros compostos de nitrogênio;

- em uma molécula ozônio O3.
Características básicas das ligações covalentes
As ligações covalentes normalmente se formam entre átomos de não metais. As principais características de uma ligação covalente são comprimento, energia, multiplicidade e direcionalidade.
Multiplicidade de ligação química
Multiplicidade de ligação química - Esse número de pares de elétrons compartilhados entre dois átomos em um composto. A multiplicidade de uma ligação pode ser determinada facilmente a partir dos valores dos átomos que formam a molécula.
Por exemplo , na molécula de hidrogênio H 2 a multiplicidade da ligação é 1, porque Cada hidrogênio possui apenas 1 elétron desemparelhado em seu nível de energia externo, portanto, um par de elétrons compartilhado é formado.
Na molécula de oxigênio O 2, a multiplicidade da ligação é 2, porque Cada átomo no nível de energia externo possui 2 elétrons desemparelhados: O=O.
Na molécula de nitrogênio N2, a multiplicidade da ligação é 3, porque entre cada átomo existem 3 elétrons desemparelhados no nível de energia externo, e os átomos formam 3 pares de elétrons comuns N≡N.
Comprimento da ligação covalente
Comprimento da ligação química
é a distância entre os centros dos núcleos dos átomos que formam a ligação. É determinado por métodos físicos experimentais. O comprimento da ligação pode ser estimado aproximadamente usando a regra de aditividade, segundo a qual o comprimento da ligação na molécula AB é aproximadamente igual à metade da soma dos comprimentos das ligações nas moléculas A 2 e B 2: 
O comprimento de uma ligação química pode ser estimado aproximadamente por raios atômicos formando um vínculo, ou pela multiplicidade de comunicação, se os raios dos átomos não forem muito diferentes.
À medida que os raios dos átomos que formam uma ligação aumentam, o comprimento da ligação aumenta.
Por exemplo
À medida que a multiplicidade de ligações entre os átomos aumenta (cujos raios atômicos não diferem ou diferem apenas ligeiramente), o comprimento da ligação diminuirá.
Por exemplo . Na série: C – C, C = C, C≡C, o comprimento da ligação diminui.
Energia de comunicação
Uma medida da força de uma ligação química é a energia da ligação. Energia de comunicação determinado pela energia necessária para quebrar uma ligação e remover os átomos que formam essa ligação a uma distância infinitamente grande um do outro.
Uma ligação covalente é muito durável. Sua energia varia de várias dezenas a várias centenas de kJ/mol. Quanto maior a energia de ligação, maior será a força de ligação e vice-versa.
A força de uma ligação química depende do comprimento da ligação, da polaridade da ligação e da multiplicidade da ligação. Quanto mais longa for uma ligação química, mais fácil será quebrá-la e quanto menor for a energia da ligação, menor será a sua resistência. Quanto mais curta for a ligação química, mais forte ela será e maior será a energia da ligação.
Por exemplo, na série de compostos HF, HCl, HBr da esquerda para a direita, a força da ligação química diminui, porque O comprimento da conexão aumenta.
Ligação química iônica

Ligação iônica é uma ligação química baseada em atração eletrostática de íons.
Íons são formados no processo de aceitação ou doação de elétrons pelos átomos. Por exemplo, os átomos de todos os metais retêm fracamente os elétrons do nível de energia externo. Portanto, os átomos de metal são caracterizados por propriedades restauradoras- capacidade de doar elétrons.

Exemplo. O átomo de sódio contém 1 elétron no nível de energia 3. Ao abandoná-lo facilmente, o átomo de sódio forma o íon Na +, muito mais estável, com a configuração eletrônica do gás nobre néon Ne. O íon sódio contém 11 prótons e apenas 10 elétrons, então a carga total do íon é -10+11 = +1:
+11N / D) 2 ) 8 ) 1 - 1e = +11 N / D +) 2 ) 8
Exemplo. Um átomo de cloro em seu nível de energia externo contém 7 elétrons. Para adquirir a configuração de um átomo de argônio inerte estável, Ar, o cloro precisa ganhar 1 elétron. Após a adição de um elétron, forma-se um íon cloro estável, composto por elétrons. A carga total do íon é -1:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Observação:
- As propriedades dos íons são diferentes das propriedades dos átomos!
- Íons estáveis podem formar não apenas átomos, mas também grupos de átomos. Por exemplo: íon amônio NH 4 +, íon sulfato SO 4 2-, etc. As ligações químicas formadas por tais íons também são consideradas iônicas;
- As ligações iônicas geralmente são formadas entre si metais E não metais(grupos não metálicos);
Os íons resultantes são atraídos devido à atração elétrica: Na + Cl -, Na 2 + SO 4 2-.
Vamos resumir visualmente diferença entre tipos de ligação covalente e iônica:


Conexão metálica é uma conexão que é formada relativamente elétrons livres entre íons metálicos, formando uma rede cristalina.
Os átomos de metal geralmente estão localizados no nível de energia externo um a três elétrons. Os raios dos átomos metálicos, via de regra, são grandes - portanto, os átomos metálicos, ao contrário dos não-metais, cedem seus elétrons externos com bastante facilidade, ou seja, são fortes agentes redutores.
Ao doar elétrons, os átomos do metal se transformam em íons carregados positivamente . Os elétrons destacados são relativamente livres estão movendo entre íons metálicos carregados positivamente. Entre essas partículas surge uma conexão, porque elétrons compartilhados mantêm cátions metálicos dispostos em camadas juntas , criando assim um forte estrutura de cristal de metal . Neste caso, os elétrons se movem continuamente de forma caótica, ou seja, Novos átomos neutros e novos cátions aparecem constantemente.

Interações intermoleculares
Separadamente, vale a pena considerar as interações que surgem entre as moléculas individuais de uma substância - interações intermoleculares . As interações intermoleculares são um tipo de interação entre átomos neutros em que nenhuma nova ligação covalente aparece. As forças de interação entre moléculas foram descobertas por Van der Waals em 1869 e receberam seu nome Forças de Van dar Waals. As forças de Van der Waals são divididas em orientação, indução E dispersivo . A energia das interações intermoleculares é muito menor que a energia das ligações químicas.
Forças de atração de orientação ocorrem entre moléculas polares (interação dipolo-dipolo). Essas forças ocorrem entre moléculas polares. Interações indutivas é a interação entre uma molécula polar e uma apolar. Uma molécula apolar é polarizada devido à ação de uma molécula polar, o que gera atração eletrostática adicional.
Um tipo especial de interação intermolecular são as ligações de hidrogênio. - são ligações químicas intermoleculares (ou intramoleculares) que surgem entre moléculas que possuem ligações covalentes altamente polares - HF, HO ou HN. Se houver tais ligações em uma molécula, então entre as moléculas haverá forças atrativas adicionais .
Mecanismo de educação a ligação de hidrogênio é parcialmente eletrostática e parcialmente doadora-aceitadora. Neste caso, o doador do par de elétrons é um átomo de um elemento fortemente eletronegativo (F, O, N), e o aceitador são os átomos de hidrogênio conectados a esses átomos. As ligações de hidrogênio são caracterizadas por foco no espaço e saturação
As ligações de hidrogênio podem ser indicadas por pontos: H ··· O. Quanto maior a eletronegatividade do átomo conectado ao hidrogênio, e quanto menor seu tamanho, mais forte será a ligação de hidrogênio. É típico principalmente para conexões flúor com hidrogênio , bem como para oxigênio e hidrogênio , menos nitrogênio com hidrogênio .

As ligações de hidrogênio ocorrem entre as seguintes substâncias:
— fluoreto de hidrogênio HF(gás, solução de fluoreto de hidrogênio em água - ácido fluorídrico), água H 2 O (vapor, gelo, água líquida):
— solução de amônia e aminas orgânicas- entre moléculas de amônia e água;
— compostos orgânicos nos quais O-H ou NH se ligam: álcoois, ácidos carboxílicos, aminas, aminoácidos, fenóis, anilina e seus derivados, proteínas, soluções de carboidratos - monossacarídeos e dissacarídeos.
A ligação de hidrogênio afeta as propriedades físicas e químicas das substâncias. Assim, a atração adicional entre as moléculas dificulta a fervura das substâncias. Substâncias com ligações de hidrogênio apresentam um aumento anormal no ponto de ebulição.
Por exemplo Via de regra, com o aumento do peso molecular, observa-se um aumento no ponto de ebulição das substâncias. No entanto, em diversas substâncias H 2 O-H 2 S-H 2 Se-H 2 Te não observamos uma mudança linear nos pontos de ebulição.

Ou seja, em o ponto de ebulição da água é anormalmente alto - não menos que -61 o C, como nos mostra a linha reta, mas muito mais, +100 o C. Esta anomalia é explicada pela presença de ligações de hidrogênio entre as moléculas de água. Portanto, em condições normais (0-20 o C) a água é líquido por estado de fase.
Conexão metálica. Propriedades da ligação metálica.
Uma ligação metálica é uma ligação química causada pela presença de elétrons relativamente livres. Característica tanto de metais puros quanto de suas ligas e compostos intermetálicos.
Mecanismo de ligação metálica
Os íons metálicos positivos estão localizados em todos os nós da rede cristalina. Entre eles, os elétrons de valência se movem aleatoriamente, como moléculas de gás, destacadas dos átomos durante a formação dos íons. Esses elétrons atuam como cimento, mantendo os íons positivos unidos; caso contrário, a rede se desintegraria sob a influência de forças repulsivas entre os íons. Ao mesmo tempo, os elétrons são mantidos por íons dentro da rede cristalina e não podem sair dela. As forças de acoplamento não são localizadas ou direcionadas. Por esta razão, na maioria dos casos aparecem números de coordenação elevados (por exemplo, 12 ou 8). Quando dois átomos de metal se aproximam, os orbitais em suas camadas externas se sobrepõem para formar orbitais moleculares. Se um terceiro átomo se aproximar, seu orbital se sobrepõe aos orbitais dos dois primeiros átomos, resultando em outro orbital molecular. Quando há muitos átomos, surge um grande número de orbitais moleculares tridimensionais, estendendo-se em todas as direções. Devido a múltiplos orbitais sobrepostos, os elétrons de valência de cada átomo são influenciados por muitos átomos.
Redes cristalinas características
A maioria dos metais forma uma das seguintes redes altamente simétricas com empacotamento próximo de átomos: cúbica de corpo centrado, cúbica de face centrada e hexagonal.
Em uma rede cúbica de corpo centrado (bcc), os átomos estão localizados nos vértices do cubo e um átomo está no centro do volume do cubo. Os metais têm uma rede cúbica de corpo centrado: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba, etc.
Em uma rede cúbica de face centrada (fcc), os átomos estão localizados nos vértices do cubo e no centro de cada face. Metais deste tipo possuem uma rede: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co, etc.
Em uma rede hexagonal, os átomos estão localizados nos vértices e no centro das bases hexagonais do prisma, e três átomos estão localizados no plano médio do prisma. Os metais possuem este empacotamento de átomos: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca, etc.
Outras propriedades
Os elétrons em movimento livre causam alta condutividade elétrica e térmica. Substâncias que possuem ligação metálica geralmente combinam resistência com plasticidade, pois quando os átomos são deslocados entre si, as ligações não se quebram. Outra propriedade importante é a romanticidade metálica.
Os metais conduzem bem o calor e a eletricidade, são fortes o suficiente e podem ser deformados sem destruição. Alguns metais são maleáveis (podem ser forjados), outros são maleáveis (você pode extrair arame deles). Essas propriedades únicas são explicadas por um tipo especial de ligação química que conecta os átomos metálicos entre si - uma ligação metálica.
Os metais no estado sólido existem na forma de cristais de íons positivos, como se “flutuassem” em um mar de elétrons que se movem livremente entre eles.
A ligação metálica explica as propriedades dos metais, em particular a sua resistência. Sob a influência de uma força deformante, uma rede metálica pode mudar sua forma sem rachar, ao contrário dos cristais iônicos.
A alta condutividade térmica dos metais é explicada pelo fato de que se um pedaço de metal for aquecido de um lado, a energia cinética dos elétrons aumentará. Este aumento de energia se espalhará no “mar de elétrons” por toda a amostra em alta velocidade.
A condutividade elétrica dos metais também fica clara. Se uma diferença de potencial for aplicada às extremidades de uma amostra de metal, a nuvem de elétrons deslocalizados se deslocará na direção do potencial positivo: esse fluxo de elétrons movendo-se em uma direção representa a corrente elétrica familiar.
Conexão metálica. Propriedades da ligação metálica. - conceito e tipos. Classificação e características da categoria “Ligação metálica. Propriedades da ligação metálica”. 2017, 2018.