پیوند یونی
(از مطالب سایت http://www.hemi.nsu.ru/ucheb138.htm استفاده شد)
پیوند یونی از طریق جاذبه الکترواستاتیکی بین یون های دارای بار مخالف اتفاق می افتد. این یون ها در نتیجه انتقال الکترون ها از یک اتم به اتم دیگر تشکیل می شوند. یک پیوند یونی بین اتمهایی تشکیل میشود که تفاوتهای زیادی در الکترونگاتیوی دارند (معمولاً بیشتر از 1.7 در مقیاس پالینگ)، به عنوان مثال، بین اتمهای فلز قلیایی و هالوژن.
اجازه دهید با استفاده از مثال تشکیل NaCl، وقوع پیوند یونی را در نظر بگیریم.
از فرمول های الکترونیکی اتم ها
Na 1s 2 2s 2 2p 6 3s 1 و
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
مشاهده می شود که برای تکمیل تراز بیرونی، اتم سدیم یک الکترون را از به دست آوردن هفت الکترون رها می کند و برای یک اتم کلر به دست آوردن یک الکترون راحت تر از به دست آوردن هفت الکترون است. در واکنش های شیمیایی، اتم سدیم یک الکترون می دهد و اتم کلر آن را می گیرد. در نتیجه، لایه های الکترونی اتم های سدیم و کلر به لایه های الکترونی پایدار گازهای نجیب تبدیل می شوند (پیکربندی الکترونیکی کاتیون سدیم
Na + 1s 2 2s 2 2p 6,
و پیکربندی الکترونیکی آنیون کلر است
Cl – - 1s 2 2s 2 2p 6 3s 2 3p 6).
برهمکنش الکترواستاتیکی یون ها منجر به تشکیل یک مولکول NaCl می شود.
ماهیت پیوند شیمیایی اغلب در حالت تجمع و خواص فیزیکی ماده منعکس می شود. ترکیبات یونی مانند کلرید سدیم NaCl سخت و نسوز هستند زیرا بین بارهای یون های "+" و "-" آنها نیروهای جاذبه الکترواستاتیکی قوی وجود دارد.
یون کلر با بار منفی نه تنها یون Na+ "خود"، بلکه سایر یون های سدیم اطراف خود را نیز جذب می کند. این منجر به این واقعیت می شود که در نزدیکی هر یک از یون ها یک یون با علامت مخالف وجود ندارد، بلکه چندین یون وجود دارد.
ساختار بلور سدیم کلرید NaCl.
در واقع در اطراف هر یون کلر 6 یون سدیم و در اطراف هر یون سدیم 6 یون کلر وجود دارد. این بسته بندی منظم یون ها، کریستال یونی نامیده می شود. اگر یک اتم کلر منفرد در یک کریستال جدا شود، در بین اتم های سدیم اطراف آن دیگر نمی توان اتمی که کلر با آن واکنش نشان می داد پیدا کرد.
یون ها که توسط نیروهای الکترواستاتیک به یکدیگر جذب می شوند، به شدت تمایلی به تغییر مکان خود تحت تأثیر نیروی خارجی یا افزایش دما ندارند. اما اگر کلرید سدیم ذوب شود و گرمایش در خلاء ادامه یابد، تبخیر شده و مولکولهای NaCl دیاتومیک را تشکیل میدهند. این نشان می دهد که نیروهای پیوند کووالانسی هرگز به طور کامل خاموش نمی شوند.
مشخصات اولیه پیوندهای یونی و خواص ترکیبات یونی
1. پیوند یونی یک پیوند شیمیایی قوی است. انرژی این پیوند در حد 300 تا 700 کیلوژول بر مول است.
2. بر خلاف پیوند کووالانسی، پیوند یونی غیر جهت دار است زیرا یک یون می تواند یون های علامت مخالف را در هر جهتی به سمت خود جذب کند.
3. بر خلاف پیوند کووالانسی، پیوند یونی اشباع نشده است، زیرا برهمکنش یون های علامت مخالف منجر به جبران کامل دوجانبه میدان های نیروی آنها نمی شود.
4. در حین تشکیل مولکول های دارای پیوند یونی، انتقال کامل الکترون ها صورت نمی گیرد، بنابراین پیوندهای یونی صد در صد در طبیعت وجود ندارد. در مولکول NaCl، پیوند شیمیایی تنها 80 درصد یونی است.
5. ترکیبات دارای پیوند یونی جامدات کریستالی هستند که نقطه ذوب و جوش بالایی دارند.
6. بیشتر ترکیبات یونی در آب محلول هستند. محلول ها و مذاب های ترکیبات یونی جریان الکتریکی را هدایت می کنند.
اتصال فلزی
بلورهای فلزی ساختار متفاوتی دارند. اگر یک قطعه فلز سدیم را بررسی کنید، متوجه می شوید که ظاهر آن با نمک خوراکی بسیار متفاوت است. سدیم فلزی نرم است که به راحتی با چاقو بریده می شود، با چکش صاف می شود، می توان آن را به راحتی در فنجان روی چراغ الکلی ذوب کرد (نقطه ذوب 97.8 درجه سانتیگراد). در یک کریستال سدیم، هر اتم توسط هشت اتم مشابه دیگر احاطه شده است.

ساختار بلوری سدیم فلزی.
شکل نشان می دهد که اتم Na در مرکز مکعب دارای 8 همسایه نزدیک است. اما همین را می توان در مورد هر اتم دیگری در کریستال گفت، زیرا همه آنها یکسان هستند. کریستال متشکل از قطعات تکرار شونده "بی نهایت" است که در این شکل نشان داده شده است.
اتم های فلز در سطح انرژی بیرونی حاوی تعداد کمی الکترون ظرفیت هستند. از آنجایی که انرژی یونیزاسیون اتمهای فلز کم است، الکترونهای ظرفیت ضعیف در این اتمها حفظ میشوند. در نتیجه، یون های دارای بار مثبت و الکترون های آزاد در شبکه کریستالی فلزات ظاهر می شوند. در این حالت، کاتیون های فلزی در گره های شبکه کریستالی قرار دارند و الکترون ها آزادانه در میدان مراکز مثبت حرکت می کنند و به اصطلاح "گاز الکترون" را تشکیل می دهند.
وجود یک الکترون با بار منفی بین دو کاتیون باعث برهمکنش هر کاتیون با این الکترون می شود.
بدین ترتیب، پیوند فلزی پیوند بین یونهای مثبت در کریستالهای فلزی است که از طریق جذب الکترونهایی که آزادانه در سراسر کریستال حرکت میکنند اتفاق میافتد.
از آنجایی که الکترون های ظرفیت در یک فلز به طور مساوی در سراسر کریستال توزیع شده اند، یک پیوند فلزی، مانند یک پیوند یونی، یک پیوند غیر جهت دار است. برخلاف پیوند کووالانسی، پیوند فلزی یک پیوند غیراشباع است. یک پیوند فلزی نیز از نظر استحکام با پیوند کووالانسی متفاوت است. انرژی یک پیوند فلزی تقریباً سه تا چهار برابر کمتر از انرژی یک پیوند کووالانسی است.
به دلیل تحرک زیاد گاز الکترون، فلزات دارای رسانایی الکتریکی و حرارتی بالایی هستند.
کریستال فلزی بسیار ساده به نظر می رسد، اما در واقع ساختار الکترونیکی آن پیچیده تر از بلورهای نمک یونی است. در لایه الکترونی خارجی عناصر فلزی الکترون کافی برای تشکیل یک پیوند کووالانسی یا یونی کامل "هشت" وجود ندارد. بنابراین، در حالت گازی، بیشتر فلزات از مولکول های تک اتمی (یعنی اتم های مجزا که به یکدیگر متصل نیستند) تشکیل شده اند. یک مثال معمولی بخار جیوه است. بنابراین، پیوند فلزی بین اتم های فلز تنها در حالت مایع و جامد تجمع رخ می دهد.
پیوند فلزی را میتوان به صورت زیر توصیف کرد: برخی از اتمهای فلز در کریستال حاصل، الکترونهای ظرفیت خود را به فضای بین اتمها میدهند (برای سدیم این ... 3s1 است)، و به یون تبدیل میشوند. از آنجایی که تمام اتم های فلز در یک کریستال یکسان هستند، هر کدام شانس یکسانی برای از دست دادن یک الکترون ظرفیت دارند.
به عبارت دیگر، انتقال الکترون ها بین اتم های فلز خنثی و یونیزه شده بدون مصرف انرژی صورت می گیرد. در این حالت، برخی از الکترونها همیشه به شکل «گاز الکترون» در فضای بین اتمها قرار میگیرند.
این الکترونهای آزاد، اولاً اتمهای فلز را در فاصله تعادلی معینی از یکدیگر نگه میدارند.
ثانیاً، آنها به فلزات یک «درخشش فلزی» مشخص میدهند (الکترونهای آزاد میتوانند با کوانتومهای نور تعامل کنند).
ثالثاً، الکترونهای آزاد فلزات را با رسانایی الکتریکی خوب تأمین میکنند. رسانایی حرارتی بالای فلزات نیز با حضور الکترون های آزاد در فضای بین اتمی توضیح داده می شود - آنها به راحتی به تغییرات انرژی "پاسخ" می دهند و به انتقال سریع آن در کریستال کمک می کنند.

یک مدل ساده از ساختار الکترونیکی یک کریستال فلزی.
******** با استفاده از فلز سدیم به عنوان مثال، اجازه دهید ماهیت پیوند فلزی را از نقطه نظر ایده هایی در مورد اوربیتال های اتمی در نظر بگیریم. اتم سدیم، مانند بسیاری از فلزات دیگر، فاقد الکترون ظرفیت است، اما اوربیتالهای ظرفیت آزاد وجود دارد. تک الکترون 3s سدیم می تواند به هر یک از اوربیتال های مجاور آزاد و نزدیک به انرژی حرکت کند. وقتی اتمهای یک کریستال به هم نزدیکتر میشوند، اوربیتالهای بیرونی اتمهای همسایه روی هم قرار میگیرند و به الکترونهای رها شده اجازه میدهند آزادانه در سراسر کریستال حرکت کنند.
با این حال، "گاز الکترون" آنقدرها هم که به نظر می رسد بی نظم نیست. الکترونهای آزاد در یک کریستال فلزی در اوربیتالهای همپوشانی قرار دارند و تا حدی مشترک هستند و چیزی شبیه پیوندهای کووالانسی را تشکیل میدهند. سدیم، پتاسیم، روبیدیم و سایر عناصر فلزی s به سادگی دارای تعداد کمی الکترون مشترک هستند، بنابراین بلورهای آنها شکننده و قابل ذوب هستند. با افزایش تعداد الکترون های ظرفیت، استحکام فلزات به طور کلی افزایش می یابد.
بنابراین، پیوندهای فلزی تمایل دارند توسط عناصری تشکیل شوند که اتمهای آنها الکترونهای ظرفیت کمی در لایه بیرونی خود دارند. این الکترون های ظرفیتی که پیوند فلزی را انجام می دهند، به قدری مشترک هستند که می توانند در سراسر کریستال فلز حرکت کنند و رسانایی الکتریکی بالایی برای فلز فراهم کنند.
کریستال NaCl جریان الکتریسیته را هدایت نمی کند زیرا در فضای بین یون ها الکترون آزاد وجود ندارد. تمام الکترون های اهدایی اتم های سدیم توسط یون های کلر محکم نگه داشته می شوند. این یکی از تفاوت های مهم بین کریستال های یونی و فلزی است.
آنچه اکنون در مورد پیوند فلزی می دانید به توضیح انعطاف پذیری (شکل پذیری) بالای بیشتر فلزات کمک می کند. فلز را می توان به صورت یک ورق نازک صاف کرد و به صورت سیم کشید. واقعیت این است که لایههای جداگانه اتمها در یک کریستال فلزی میتوانند نسبتاً به راحتی یکدیگر را بلغزند: «گاز الکترونی» متحرک دائماً حرکت یونهای مثبت منفرد را نرم میکند و آنها را از یکدیگر محافظت میکند.
البته با نمک خوراکی نمی توان چنین کاری کرد، البته نمک نیز یک ماده کریستالی است. در کریستال های یونی، الکترون های ظرفیت به طور محکم به هسته اتم متصل هستند. جابجایی یک لایه از یون ها نسبت به لایه دیگر، یون های دارای بار مشابه را به هم نزدیک می کند و باعث دافعه قوی بین آنها می شود و در نتیجه کریستال از بین می رود (NaCl ماده ای شکننده است).

جابجایی لایه های یک کریستال یونی باعث پیدایش نیروهای دافعه بزرگ بین یون های مشابه و تخریب کریستال می شود.
جهت یابی
- حل مسائل ترکیبی بر اساس ویژگی های کمی یک ماده
- حل مسئله. قانون ثبات ترکیب مواد. محاسبات با استفاده از مفاهیم "جرم مولی" و "مقدار شیمیایی" یک ماده
هدف از درس
- یک ایده از پیوند شیمیایی فلز بدهید.
- یاد بگیرید که الگوهای تشکیل پیوند فلزی را یادداشت کنید.
- با خواص فیزیکی فلزات آشنا شوید.
- یاد بگیرید که به وضوح بین گونه ها تمایز قائل شوید پیوندهای شیمیایی .
اهداف درس
- نحوه تعامل آنها با یکدیگر را بیابید اتم های فلزی
- تعیین کنید که چگونه یک پیوند فلزی بر خواص مواد تشکیل شده توسط آن تأثیر می گذارد
شرایط کلیدی:
- الکترونگاتیوی - یک ویژگی شیمیایی یک اتم، که مشخصه کمی توانایی یک اتم در یک مولکول برای جذب جفت الکترون های مشترک است.
- پیوند شیمیایی -پدیده برهمکنش اتم ها به دلیل همپوشانی ابرهای الکترونی اتم های برهم کنش.
- اتصال فلزی پیوندی در فلزات بین اتم ها و یون ها است که از طریق اشتراک الکترون ها ایجاد می شود.
- پیوند کووالانسی - یک پیوند شیمیایی که از همپوشانی یک جفت الکترون ظرفیتی تشکیل شده است. الکترون هایی که اتصال را ایجاد می کنند جفت الکترون مشترک نامیده می شوند. دو نوع وجود دارد: قطبی و غیر قطبی.
- پیوند یونی - یک پیوند شیمیایی که بین اتم های غیر فلزی تشکیل می شود، که در آن یک جفت الکترون مشترک به اتمی با الکترونگاتیوی بالاتر می رود. در نتیجه، اتم ها مانند اجسام دارای بار مخالف جذب می شوند.
- پیوند هیدروژنی
- پیوند شیمیایی بین یک اتم الکترونگاتیو و یک اتم هیدروژن H که به صورت کووالانسی به اتم الکترونگاتیو دیگری پیوند خورده است. اتم های الکترونگاتیو می توانند N، O یا F باشند. پیوندهای هیدروژنی می توانند بین مولکولی یا درون مولکولی باشند.
در طول کلاس ها
پیوند شیمیایی فلز
عناصری را که در «صف» اشتباه هستند، شناسایی کنید چرا؟
Ca Fe P K Al Mg Na
کدام عناصر از جدول مندلیففلزات نامیده می شوند؟
امروز می آموزیم که فلزات چه خواصی دارند و چگونه به پیوندی که بین یون های فلزی تشکیل می شود بستگی دارند.
ابتدا بیایید مکان فلزات در جدول تناوبی را به خاطر بیاوریم؟
همانطور که همه می دانیم فلزات معمولاً به صورت اتم های جدا شده نیستند، بلکه به صورت یک قطعه، شمش یا محصول فلزی وجود دارند. بیایید دریابیم که چه چیزی اتم های فلز را در حجم کامل جمع می کند.
در مثال ما یک تکه طلا را می بینیم. و به هر حال، طلا یک فلز منحصر به فرد است. با استفاده از آهنگری، می توان از طلای خالص برای ساخت فویل با ضخامت 0.002 میلی متر استفاده کرد! این ورق نازک فویل تقریباً شفاف است و در نور یک رنگ سبز دارد. در نتیجه، از یک شمش طلا به اندازه یک قوطی کبریت، می توانید یک فویل نازک به دست آورید که مساحت زمین تنیس را می پوشاند.
از نظر شیمیایی، همه فلزات با سهولت از دست دادن الکترونهای ظرفیت مشخص میشوند و در نتیجه، یونهایی با بار مثبت تشکیل میشوند و فقط اکسیداسیون مثبت از خود نشان میدهند. به همین دلیل است که فلزات در حالت آزاد عامل کاهنده هستند. ویژگی مشترک اتم های فلزی اندازه بزرگ آنها نسبت به غیر فلزات است. الکترون های بیرونی در فواصل زیادی از هسته قرار دارند و به همین دلیل ضعیف به آن متصل هستند، بنابراین به راحتی از هم جدا می شوند.
اتم های تعداد بیشتری از فلزات در سطح خارجی دارای تعداد کمی الکترون هستند - 1،2،3. این الکترون ها به راحتی از بین می روند و اتم های فلز به یون تبدیل می شوند.
Ме0 – n ē ⇆ مردان +
اتم های فلزی – الکترون های بیرونی مدار ⇆ یون های فلزی
به این ترتیب، الکترون های جدا شده می توانند از یک یون به یون دیگر حرکت کنند، یعنی آزاد می شوند، گویی آنها را به یک کل واحد پیوند می دهند، بنابراین معلوم می شود که همه الکترون های جدا شده مشترک هستند، زیرا درک آن غیر ممکن است. کدام الکترون متعلق به کدام یک از اتم های فلز است.
الکترونها میتوانند با کاتیونها ترکیب شوند، سپس اتمها به طور موقت تشکیل میشوند و سپس الکترونها از آن جدا میشوند. این فرآیند به طور مداوم و بدون توقف اتفاق می افتد. معلوم می شود که در حجم فلز، اتم ها به طور مداوم به یون تبدیل می شوند و بالعکس. در این حالت تعداد کمی از الکترون های مشترک تعداد زیادی اتم و یون فلز را به هم متصل می کنند. اما مهم است که تعداد الکترون های فلز برابر با بار کل یون های مثبت باشد، یعنی معلوم شود که به طور کلی فلز از نظر الکتریکی خنثی می ماند.
این فرآیند به عنوان یک مدل ارائه می شود - یون های فلزی در ابری از الکترون ها قرار دارند. چنین ابر الکترونی "گاز الکترونی" نامیده می شود.
به عنوان مثال، در این تصویر می بینیم که چگونه الکترون ها در میان یون های بی حرکت در داخل شبکه کریستالی فلز حرکت می کنند. 
برنج. 2. حرکت الکترون
برای اینکه بهتر بفهمیم گاز الکترون چیست و چگونه در واکنش های شیمیایی فلزات مختلف رفتار می کند، ویدئوی جالبی را تماشا می کنیم. (در این ویدیو فقط به رنگ طلایی اشاره شده است!)
اکنون میتوانیم این تعریف را بنویسیم: پیوند فلزی پیوندی در فلزات بین اتمها و یونها است که از اشتراک الکترونها تشکیل میشود.
بیایید انواع اتصالاتی را که می شناسیم با هم مقایسه کنیم و آنها را تثبیت کنیم تا آنها را بهتر تشخیص دهیم، برای این ما ویدیو را تماشا خواهیم کرد.
پیوند فلزی نه تنها در فلزات خالص اتفاق می افتد، بلکه مشخصه مخلوط فلزات و آلیاژهای مختلف در حالت های مختلف تجمع است.
پیوند فلزی مهم است و خصوصیات اساسی فلزات را تعیین می کند
رسانایی الکتریکی - حرکت تصادفی الکترون ها در حجم فلز. اما با اختلاف پتانسیل کوچک، به طوری که الکترون ها به صورت منظم حرکت می کنند. فلزات با بهترین رسانایی عبارتند از Ag، Cu، Au، Al.
- پلاستیسیته
پیوندهای بین لایه های فلزی چندان قابل توجه نیست، این به لایه ها اجازه می دهد تا تحت بار حرکت کنند (فلز را بدون شکستن تغییر شکل دهند). بهترین فلزات قابل تغییر شکل (نرم) طلا، نقره، مس هستند.
- درخشش فلزی
گاز الکترون تقریباً تمام پرتوهای نور را منعکس می کند. به همین دلیل است که فلزات خالص بسیار می درخشند و اغلب رنگ خاکستری یا سفید دارند. فلزاتی که بهترین منعکس کننده های نقره، مس، آل، پالادیم، جیوه هستند
مشق شب
تمرین 1
فرمول موادی که دارند را انتخاب کنید
الف) پیوند قطبی کووالانسی: Cl2، KCl، NH3، O2، MgO، CCl4، SO2.
ب) با پیوند یونی: HCl، KBr، P4، H2S، Na2O، CO2، CaS.
تمرین 2
موارد اضافی را خط بزنید:
الف) CuCl2، Al، MgS
ب) N2، HCl، O2
ج) Ca، CO2، Fe
د) MgCl2، NH3، H2
فلز سدیم، فلز لیتیوم و سایر فلزات قلیایی رنگ شعله را تغییر می دهند. لیتیوم فلزی و نمک های آن به آتش رنگ قرمز می دهند، نمک های فلزی سدیم و سدیم به آن رنگ زرد، پتاسیم فلزی و نمک های آن رنگ ارغوانی و روبیدیم و سزیم به آن رنگ ارغوانی، اما روشن تر می دهند.
برنج. 4. یک قطعه فلز لیتیوم 
برنج. 5. رنگ آمیزی شعله با فلزات
لیتیوم (Li). فلز لیتیوم مانند فلز سدیم یک فلز قلیایی است. هر دو در آب محلول هستند. هنگامی که سدیم در آب حل می شود، سود سوزآور را تشکیل می دهد که یک اسید بسیار قوی است. هنگامی که فلزات قلیایی در آب حل می شوند، گرما و گاز (هیدروژن) زیادی آزاد می شود. توصیه می شود این فلزات را با دستان خود لمس نکنید، زیرا ممکن است دچار سوختگی شوید.
کتابشناسی - فهرست کتب
1. درس با موضوع "پیوند شیمیایی فلزی"، معلم شیمی توختا والنتینا آناتولیونا "مدرسه متوسطه Yesenovichskaya"
2. F. A. Derkach "شیمی" - کتابچه راهنمای علمی و روش شناختی. - کیف، 2008.
3. L. B. Tsvetkova "شیمی معدنی" - ویرایش 2، تصحیح و گسترش یافته است. - لووف، 2006.
4. V. V. Malinovsky، P. G. Nagorny "شیمی معدنی" - کیف، 2009.
5. گلینکا N.L. شیمی عمومی. – چاپ بیست و هفتم/زیر. ویرایش V.A. رابینوویچ – L.: Chemistry, 2008. – 704 pp.
ویرایش و ارسال توسط Lisnyak A.V.
روی درس کار کرد:
توختا V.A.
Lisnyak A.V.
می توانید در مورد آموزش مدرن سؤالی مطرح کنید، ایده ای را بیان کنید یا یک مشکل مبرم را حل کنید انجمن آموزشی، جایی که شورای آموزشی اندیشه و عمل تازه در سطح بین المللی تشکیل جلسه می دهد. ایجاد کرده است وبلاگ شیمی پایه هشتم
اتصال فلزی
در نتیجه جاذبه الکترواستاتیکی بین کاتیون و آنیون، یک مولکول تشکیل می شود.
پیوند یونی
نظریه پیوند یونی توسط 1916 . دانشمند آلمانی W. Kossel. این نظریه شکل گیری ارتباطات بین اتم های فلزات و اتم های معمولیمعمول غیر فلزات: CsF، CsCl، NaCl، KF، KCl، Na 2 O و غیره.
بر اساس این نظریه، زمانی که یک پیوند یونی تشکیل میشود، اتمهای فلزات معمولی الکترون را ترک میکنند و اتمهای نافلزات معمولی الکترون را میپذیرند.
در نتیجه این فرآیندها، اتم های فلز به ذرات با بار مثبت تبدیل می شوند که به آنها یون یا کاتیون مثبت می گویند. و اتم های غیر فلزی به یون های منفی - آنیون تبدیل می شوند. بار کاتیون برابر است با تعداد الکترون های داده شده.
اتم های فلزی به لایه بیرونی خود الکترون می دهند و یون های حاصل دارای ساختارهای الکترونیکی کامل هستند (لایه الکترونیکی قبل از بیرون).
مقدار بار منفی آنیون برابر با تعداد الکترون های پذیرفته شده است.
اتم های غیر فلزی تعداد الکترون هایی را می پذیرند که برای آنها بسیار مهم است تکمیل یک اکتت الکترونیکی (لایه الکترونیکی بیرونی).
به عنوان مثال: طرح کلی برای تشکیل یک مولکول NaCl از اتم های Na و C1: Na°-le = Na +1 تشکیل یون ها
Сl°+1е - = Сl -
Na +1 + Cl - = Na + Cl -
Na°+ Сl°= Na + Сl - ترکیب یونها
· پیوند بین یون ها معمولاً پیوند یونی نامیده می شود.
ترکیباتی که از یون تشکیل شده اند نامیده می شوند ترکیبات یونی
مجموع جبری بارهای تمام یونهای موجود در مولکول یک ترکیب یونی باید برابر با صفر باشد،زیرا هر مولکولی یک ذره خنثی الکتریکی است.
هیچ مرز مشخصی بین پیوندهای یونی و کووالانسی وجود ندارد. یک پیوند یونی را می توان به عنوان یک مورد شدید از یک پیوند کووالانسی قطبی در نظر گرفت که در آن یک جفت الکترون مشترک تشکیل می شود. به صورت کاملبه سمت اتم با الکترونگاتیوی بالاتر حرکت می کند.
اکثر اتم های فلزی معمولی تعداد کمی الکترون در لایه الکترونی بیرونی خود دارند (معمولاً 1 تا 3). این الکترون ها الکترون های ظرفیتی نامیده می شوند. در اتم های فلزی، استحکام پیوند بین الکترون های ظرفیت و هسته کم است، یعنی اتم ها انرژی یونیزاسیون کمی دارند. این باعث می شود که الکترون های ظرفیت از بین بروند ساعتتبدیل اتم های فلز به یون های دارای بار مثبت (کاتیون ها):
Ме° -ne ® Ме n +
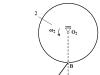
در ساختار بلوری یک فلز، الکترون های ظرفیتی این قابلیت را دارند که به راحتی از یک اتم به اتم دیگر حرکت کنند که منجر به اشتراک الکترون ها توسط تمام اتم های همسایه می شود. به روشی ساده، ساختار یک کریستال فلزی به صورت زیر نشان داده می شود: در گره های شبکه کریستالی یون های Me n+ و اتم های Me° وجود دارند و الکترون های ظرفیت نسبتاً آزادانه بین آنها حرکت می کنند و بین همه اتم ها و یون های آن ارتباط برقرار می کنند. فلز (شکل 3). این نوع خاصی از پیوند شیمیایی به نام پیوند فلزی است.
· پیوند فلزی - پیوندی بین اتم ها و یون های فلزات در یک شبکه کریستالی که توسط الکترون های ظرفیت مشترک انجام می شود.
به لطف این نوع پیوند شیمیایی، فلزات دارای مجموعه خاصی از خواص فیزیکی و شیمیایی هستند که آنها را از غیر فلزات متمایز می کند.
 برنج. 3. نمودار شبکه کریستالی فلزات.
برنج. 3. نمودار شبکه کریستالی فلزات.
استحکام پیوند فلزی، پایداری شبکه کریستالی و انعطاف پذیری فلزات (قابلیت انجام پردازش های مختلف بدون تخریب) را تضمین می کند. حرکت آزاد الکترون های ظرفیت به فلزات اجازه می دهد الکتریسیته و گرما را به خوبی هدایت کنند. توانایی بازتاب امواج نور (ᴛ.ᴇ. درخشش فلزی) نیز با ساختار شبکه کریستالی فلز توضیح داده می شود.
با این حال، مشخص ترین خواص فیزیکی فلزات بر اساس وجود پیوند فلزی عبارتند از:
■ ساختار کریستالی.
■درخشش و شفافیت فلزی.
■ انعطاف پذیری، چکش خواری، همجوشی.
■ هدایت الکتریکی و حرارتی بالا. و تمایل به تشکیل آلیاژ.
پیوند فلزی - مفهوم و انواع. طبقه بندی و ویژگی های دسته "اتصال فلزی" 2017، 2018.
خود نام "پیوند فلزی" نشان می دهد که ما در مورد ساختار داخلی فلزات صحبت می کنیم. اتمهای اکثر فلزات در سطح انرژی بیرونی حاوی تعداد کمی الکترون ظرفیتی در مقایسه با تعداد کل الکترونهای بیرونی هستند که از نظر انرژی نزدیک هستند... .
پیوند فلزی مبتنی بر اشتراک الکترون های ظرفیتی است که نه به دو بلکه به تقریباً تمام اتم های فلز در کریستال تعلق دارند. در فلزات، الکترون های ظرفیت بسیار کمتری نسبت به اوربیتال های آزاد وجود دارد. این شرایط را برای حرکت آزاد ایجاد می کند... .
اطلاعات ضروری در مورد ماهیت پیوندهای شیمیایی در فلزات را می توان بر اساس دو ویژگی مشخصه در مقایسه با ترکیبات کووالانسی و یونی به دست آورد. فلزات اولاً از نظر رسانایی الکتریکی بالا با سایر مواد تفاوت دارند و... .
اطلاعات قابل توجهی در مورد ماهیت پیوندهای شیمیایی در فلزات بر اساس دو ویژگی مشخصه آنها در مقایسه با ترکیبات کووالانسی و یونی بدست می آید. فلزات اولاً از نظر رسانایی الکتریکی بالا با سایر مواد تفاوت دارند و... .
هیبریداسیون اوربیتالها و پیکربندی فضایی مولکولها نوع مولکول اوربیتالهای اولیه اتم نوع هیبریداسیون تعداد اوربیتالهای ترکیبی اتم A پیکربندی فضایی مولکول AB2 AB3 AB4 s + p s + p + p s + p + p + p + p ....
پیوند فلزی یک پیوند شیمیایی است که در اثر حضور الکترونهای نسبتاً آزاد ایجاد میشود. مشخصه هم فلزات خالص و هم آلیاژها و ترکیبات بین فلزی آنهاست. مکانیسم پیوند فلزی در تمام گره های شبکه کریستالی... .
یک مولکول کوچکترین ذره یک ماده است که دارای خواص شیمیایی است. طبق تئوری پیوند شیمیایی، حالت پایدار یک عنصر با ساختاری با فرمول الکترونیکی سطح بیرونی s2p6 (آرگون، کریپتون، رادون و غیره) مطابقت دارد. در دوران تحصیل... .
موضوعات کد کننده آزمون دولتی واحد: پیوند شیمیایی کووالانسی، انواع و مکانیسم های تشکیل آن. ویژگی های پیوندهای کووالانسی (قطبیت و انرژی پیوند). پیوند یونی. اتصال فلزی. پیوند هیدروژنی
پیوندهای شیمیایی درون مولکولی
ابتدا، بیایید به پیوندهایی که بین ذرات درون مولکول ها ایجاد می شود نگاه کنیم. چنین اتصالاتی نامیده می شود درون مولکولی.
پیوند شیمیایی بین اتم های عناصر شیمیایی ماهیت الکترواستاتیکی دارد و به دلیل تشکیل می شود برهمکنش الکترون های خارجی ( ظرفیت )، در درجه کم و بیش توسط هسته های دارای بار مثبت نگهداری می شوداتم های پیوند خورده
مفهوم کلیدی اینجاست نگاتیوی الکتریکی. این است که نوع پیوند شیمیایی بین اتم ها و خواص این پیوند را تعیین می کند.
توانایی یک اتم برای جذب (نگه داشتن) است خارجی(ظرفیت) الکترون ها. الکترونگاتیوی با درجه جذب الکترون های بیرونی به هسته تعیین می شود و در درجه اول به شعاع اتم و بار هسته بستگی دارد.
تعیین الکترونگاتیوی به طور واضح دشوار است. L. Pauling جدولی از الکترونگاتیوی نسبی (بر اساس انرژی پیوند مولکولهای دو اتمی) تهیه کرد. الکترونگاتیوترین عنصر است فلوئوربا معنی 4 .
توجه به این نکته ضروری است که در منابع مختلف می توانید مقیاس ها و جداول متفاوتی از مقادیر الکترونگاتیوی را پیدا کنید. این نباید نگران باشد، زیرا تشکیل یک پیوند شیمیایی نقش مهمی دارد اتم ها، و تقریباً در هر سیستمی یکسان است.
اگر یکی از اتم های پیوند شیمیایی A:B الکترون ها را با شدت بیشتری جذب کند، آنگاه جفت الکترون به سمت آن حرکت می کند. بیشتر اختلاف الکترونگاتیویاتم ها، جفت الکترون بیشتر جابجا می شود.
اگر الکترونگاتیوی اتم های برهم کنش مساوی یا تقریباً برابر باشد: EO(A)≈EO(B)، سپس جفت الکترون مشترک به هیچ یک از اتم ها تغییر نمی کند: الف: ب. این ارتباط نامیده می شود کووالانسی غیرقطبی
اگر الکترونگاتیوی اتم های برهم کنش متفاوت باشد، اما نه زیاد (تفاوت در الکترونگاتیوی تقریباً از 0.4 تا 2 است: 0,4<ΔЭО<2 ، سپس جفت الکترون به یکی از اتم ها جابه جا می شود. این ارتباط نامیده می شود قطبی کووالانسی .
اگر الکترونگاتیوی اتم های برهم کنش به طور قابل توجهی متفاوت باشد (تفاوت در الکترونگاتیوی بیشتر از 2 است: ΔEO>2) سپس یکی از الکترون ها با تشکیل تقریباً به طور کامل به اتم دیگری منتقل می شود یون ها. این ارتباط نامیده می شود یونی.
انواع پایه پیوندهای شیمیایی - کووالانسی, یونیو فلزارتباطات بیایید نگاهی دقیق تر به آنها بیندازیم.
پیوند شیمیایی کووالانسی
پیوند کووالانسی – این یک پیوند شیمیایی است ، شکل گرفته به دلیل تشکیل یک جفت الکترون مشترک A:B . علاوه بر این، دو اتم همپوشانیاوربیتال های اتمی یک پیوند کووالانسی از برهمکنش اتم ها با اختلاف الکترونگاتیوی کوچک (معمولاً بین دو نافلز) یا اتم های یک عنصر.
خواص اساسی پیوندهای کووالانسی
- تمرکز,
- اشباع پذیری,
- قطبیت,
- قطبی پذیری.
این خواص پیوندی بر خواص شیمیایی و فیزیکی مواد تأثیر می گذارد.
جهت ارتباط ساختار شیمیایی و شکل مواد را مشخص می کند. زوایای بین دو پیوند را زوایای پیوند می گویند. برای مثال، در یک مولکول آب، زاویه پیوند H-O-H 104.45 o است، بنابراین مولکول آب قطبی است، و در یک مولکول متان، زاویه پیوند H-C-H 108 o 28' است.

اشباع پذیری توانایی اتم ها برای تشکیل تعداد محدودی پیوند شیمیایی کووالانسی است. به تعداد پیوندهایی که یک اتم می تواند تشکیل دهد گفته می شود.
قطبیتپیوند به دلیل توزیع ناهموار چگالی الکترون بین دو اتم با الکترونگاتیوی متفاوت اتفاق می افتد. پیوندهای کووالانسی به دو دسته قطبی و غیرقطبی تقسیم می شوند.
قطبی پذیری اتصالات هستند توانایی الکترون های پیوند برای جابجایی تحت تأثیر میدان الکتریکی خارجی(به ویژه میدان الکتریکی یک ذره دیگر). قطبش پذیری به تحرک الکترون بستگی دارد. هر چه الکترون از هسته دورتر باشد، تحرک بیشتری دارد و بر این اساس مولکول قطبی پذیرتر است.

پیوند شیمیایی غیرقطبی کووالانسی
2 نوع پیوند کووالانسی وجود دارد - قطبیو غیر قطبی .
مثال . بیایید ساختار مولکول هیدروژن H2 را در نظر بگیریم. هر اتم هیدروژن در سطح انرژی بیرونی خود حامل 1 الکترون جفت نشده است. برای نمایش یک اتم، از ساختار لوئیس استفاده می کنیم - این نموداری از ساختار سطح انرژی بیرونی یک اتم است، زمانی که الکترون ها با نقطه نشان داده می شوند. مدلهای ساختار نقطهای لوئیس هنگام کار با عناصر دوره دوم کاملاً مفید هستند.
اچ. + . H = H: H
بنابراین، یک مولکول هیدروژن یک جفت الکترون مشترک و یک پیوند شیمیایی H-H دارد. این جفت الکترون به هیچ یک از اتم های هیدروژن جابجا نمی شود، زیرا اتم های هیدروژن الکترونگاتیوی یکسانی دارند. این ارتباط نامیده می شود کووالانسی غیرقطبی .

پیوند کووالانسی غیرقطبی (متقارن). یک پیوند کووالانسی است که توسط اتمهایی با الکترونگاتیوی برابر (معمولاً همان نافلزات) و بنابراین با توزیع یکنواخت چگالی الکترون بین هستههای اتمها تشکیل میشود.
گشتاور دوقطبی پیوندهای غیر قطبی 0 است.
مثال ها: H 2 (H-H)، O 2 (O=O)، S 8.
پیوند شیمیایی قطبی کووالانسی
پیوند قطبی کووالانسی یک پیوند کووالانسی است که بین اتم هایی با الکترونگاتیوی متفاوت (معمولا، انواع غیر فلزات) و مشخص می شود جابه جاییجفت الکترون مشترک به یک اتم الکترونگاتیو تر (قطبی شدن).
چگالی الکترون به اتم الکترونگاتیو تر منتقل می شود - بنابراین، یک بار منفی جزئی (δ-) روی آن ظاهر می شود و یک بار مثبت جزئی (δ+، دلتا +) روی اتم کمتر الکترونگاتیو ظاهر می شود.
هر چه اختلاف الکترونگاتیوی اتم ها بیشتر باشد، بیشتر است قطبیتاتصالات و موارد دیگر لحظه دوقطبی . نیروهای جاذبه اضافی بین مولکول های همسایه و بارهای علامت مخالف عمل می کنند که افزایش می یابد استحکام - قدرتارتباطات
قطبیت پیوند بر خواص فیزیکی و شیمیایی ترکیبات تأثیر می گذارد. مکانیسم واکنش و حتی واکنش پذیری پیوندهای همسایه به قطبیت پیوند بستگی دارد. قطبیت اتصال اغلب تعیین می کند قطبیت مولکولو بنابراین مستقیماً بر خواص فیزیکی مانند نقطه جوش و نقطه ذوب، حلالیت در حلال های قطبی تأثیر می گذارد.
مثال ها: HCl، CO 2، NH 3.
مکانیسم های تشکیل پیوند کووالانسی
پیوندهای شیمیایی کووالانسی می توانند با 2 مکانیسم ایجاد شوند:
1. مکانیسم مبادله تشکیل یک پیوند شیمیایی کووالانسی زمانی است که هر ذره یک الکترون جفت نشده برای تشکیل یک جفت الکترون مشترک فراهم می کند:
آ . + . B= A:B
2. تشکیل پیوند کووالانسی مکانیزمی است که در آن یکی از ذرات یک جفت الکترون تنها و ذره دیگر یک اوربیتال خالی برای این جفت الکترون فراهم می کند:
آ: + B= A:B

در این مورد، یکی از اتم ها یک جفت الکترون تنها ( اهدا کننده) و اتم دیگر یک مدار خالی برای آن جفت فراهم می کند ( پذیرنده). در نتیجه تشکیل هر دو پیوند، انرژی الکترون ها کاهش می یابد، یعنی. این برای اتم ها مفید است.
یک پیوند کووالانسی که توسط مکانیسم دهنده - گیرنده ایجاد می شود متفاوت نیستدر خواص از سایر پیوندهای کووالانسی که توسط مکانیسم تبادل ایجاد می شود. تشکیل پیوند کووالانسی توسط مکانیسم دهنده-گیرنده برای اتم هایی با تعداد زیادی الکترون در سطح انرژی خارجی (الکترون دهنده) یا برعکس، با تعداد بسیار کمی الکترون (پذیرنده های الکترون) معمول است. قابلیت های ظرفیت اتم ها با جزئیات بیشتری در بخش مربوطه مورد بحث قرار گرفته است.
یک پیوند کووالانسی توسط مکانیسم دهنده - گیرنده تشکیل می شود:
- در یک مولکول مونوکسید کربن CO(پیوند در مولکول سه گانه است، 2 پیوند توسط مکانیسم تبادل، یکی توسط مکانیسم دهنده - گیرنده ایجاد می شود): C≡O;
- V یون آمونیوم NH 4 +، در یون آمین های آلیبه عنوان مثال، در یون متیل آمونیوم CH 3 -NH 2 + ;
- V ترکیبات پیچیدهیک پیوند شیمیایی بین اتم مرکزی و گروه لیگاند، به عنوان مثال، در سدیم تتراهیدروکسوآلومینات سدیم پیوند بین یون های آلومینیوم و هیدروکسید.
- V اسید نیتریک و نمک های آن- نیترات ها: HNO 3، NaNO 3، در برخی از ترکیبات نیتروژن دیگر.

- در یک مولکول ازن O3.
ویژگی های اساسی پیوندهای کووالانسی
پیوندهای کووالانسی معمولاً بین اتم های غیرفلز تشکیل می شود. ویژگی های اصلی پیوند کووالانسی عبارتند از طول، انرژی، تعدد و جهت.
تعدد پیوند شیمیایی
تعدد پیوند شیمیایی - این تعداد جفت الکترون های مشترک بین دو اتم در یک ترکیب. تعدد یک پیوند را می توان به راحتی از روی مقادیر اتم هایی که مولکول را تشکیل می دهند تعیین کرد.
مثلا ، در مولکول هیدروژن H 2 تعدد پیوند 1 است، زیرا هر هیدروژن فقط 1 الکترون جفت نشده در سطح انرژی بیرونی خود دارد، بنابراین یک جفت الکترون مشترک تشکیل می شود.
در مولکول اکسیژن O 2، تعدد پیوند 2 است، زیرا هر اتم در سطح انرژی بیرونی دارای 2 الکترون جفت نشده است: O=O.
در مولکول نیتروژن N2، تعدد پیوند 3 است، زیرا بین هر اتم 3 الکترون جفت نشده در سطح انرژی بیرونی وجود دارد و اتم ها 3 جفت الکترون مشترک N≡N را تشکیل می دهند.
طول پیوند کووالانسی
طول پیوند شیمیایی
فاصله بین مراکز هسته اتم های تشکیل دهنده پیوند است. با روش های فیزیکی تجربی تعیین می شود. طول پیوند را می توان تقریباً با استفاده از قانون افزایشی تخمین زد که طبق آن طول پیوند در مولکول AB تقریباً برابر با نصف مجموع طول پیوند در مولکول های A 2 و B 2 است: 
طول یک پیوند شیمیایی را می توان تقریباً تخمین زد توسط شعاع اتمیتشکیل یک پیوند، یا با تعدد ارتباطات، اگر شعاع اتم ها خیلی متفاوت نباشد.
با افزایش شعاع اتم های تشکیل دهنده پیوند، طول پیوند افزایش می یابد.
مثلا
با افزایش تعدد پیوندهای بین اتم ها (شعاع های اتمی آن ها تفاوتی ندارند یا فقط اندکی با هم تفاوت دارند)، طول پیوند کاهش می یابد.
مثلا . در سریهای C–C، C=C، C≡C، طول پیوند کاهش مییابد.
انرژی ارتباطی
معیار قدرت یک پیوند شیمیایی، انرژی پیوند است. انرژی ارتباطی با انرژی مورد نیاز برای شکستن یک پیوند و حذف اتم های تشکیل دهنده آن پیوند در فاصله بی نهایت زیادی از یکدیگر تعیین می شود.
پیوند کووالانسی است بسیار بادوامانرژی آن از چند ده تا چند صد کیلوژول بر مول متغیر است. هر چه انرژی پیوند بیشتر باشد، استحکام پیوند بیشتر است و بالعکس.
استحکام یک پیوند شیمیایی به طول پیوند، قطبیت پیوند و تعدد پیوند بستگی دارد. هر چه یک پیوند شیمیایی طولانی تر باشد، شکستن آن آسان تر است و هر چه انرژی پیوند کمتر باشد، استحکام آن کمتر می شود. هرچه پیوند شیمیایی کوتاه تر باشد، قوی تر است و انرژی پیوند بیشتر است.
مثلا، در سری ترکیبات HF، HCl، HBr از چپ به راست، استحکام پیوند شیمیایی کاهش می دهد، زیرا طول اتصال افزایش می یابد.
پیوند شیمیایی یونی

پیوند یونی یک پیوند شیمیایی است که بر اساس جاذبه الکترواستاتیکی یونها.
یون هادر فرآیند پذیرش یا اهدای الکترون توسط اتم ها تشکیل می شوند. به عنوان مثال، اتم های تمام فلزات به طور ضعیفی الکترون ها را از سطح انرژی بیرونی نگه می دارند. بنابراین، اتم های فلزی با خواص ترمیمی- توانایی اهدای الکترون

مثال. اتم سدیم دارای 1 الکترون در سطح انرژی 3 است. اتم سدیم با رها کردن آسان آن، یون Na + بسیار پایدارتر را با پیکربندی الکترونی گاز نجیب نئون Ne تشکیل میدهد. یون سدیم حاوی 11 پروتون و تنها 10 الکترون است، بنابراین بار کل یون -10+11 = +1 است:
+11Na) 2 ) 8 ) 1 - 1e = +11 Na +) 2 ) 8
مثال. یک اتم کلر در سطح انرژی بیرونی خود حاوی 7 الکترون است. برای به دست آوردن پیکربندی یک اتم آرگون بی اثر پایدار Ar، کلر باید 1 الکترون به دست آورد. پس از افزودن یک الکترون، یک یون کلر پایدار تشکیل می شود که از الکترون ها تشکیل شده است. بار کل یون -1 است:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
توجه داشته باشید:
- خواص یون ها با خواص اتم ها متفاوت است!
- یون های پایدار نه تنها می توانند تشکیل شوند اتم ها، اما همچنین گروه های اتم. به عنوان مثال: یون آمونیوم NH 4 +، یون سولفات SO 4 2-، و غیره. پیوندهای شیمیایی تشکیل شده توسط چنین یون هایی نیز یونی در نظر گرفته می شوند.
- پیوندهای یونی معمولاً بین یکدیگر تشکیل می شوند فلزاتو غیر فلزات(گروه های غیر فلزی)؛
یون های حاصل به دلیل جاذبه الکتریکی جذب می شوند: Na + Cl -، Na 2 + SO 4 2-.
اجازه دهید به صورت بصری خلاصه کنیم تفاوت بین انواع پیوند کووالانسی و یونی:


اتصال فلزی ارتباطی است که به طور نسبی شکل می گیرد الکترون های آزادبین یون های فلزی، تشکیل یک شبکه کریستالی.
اتم های فلزات معمولا در سطح انرژی بیرونی قرار دارند یک تا سه الکترون. شعاع اتم های فلز، به عنوان یک قاعده، بزرگ است - بنابراین، اتم های فلز، بر خلاف غیر فلزات، الکترون های بیرونی خود را به راحتی از دست می دهند، یعنی. عوامل کاهنده قوی هستند.
با اهدای الکترون، اتم های فلز تبدیل می شوند یون های دارای بار مثبت . الکترون های جدا شده نسبتاً آزاد هستند در حال حرکت هستندبین یون های فلزی با بار مثبت بین این ذرات یک ارتباط بوجود می آید، زیرا الکترونهای مشترک کاتیونهای فلزی را که در لایههایی کنار هم قرار گرفتهاند، نگه میدارند ، بنابراین ایجاد یک نسبتا قوی است شبکه کریستالی فلزی . در این حالت، الکترون ها به طور پیوسته به صورت آشفته حرکت می کنند، یعنی. اتم های خنثی جدید و کاتیون های جدید دائما ظاهر می شوند.

فعل و انفعالات بین مولکولی
به طور جداگانه، ارزش در نظر گرفتن فعل و انفعالاتی که بین مولکول های فردی در یک ماده ایجاد می شود - فعل و انفعالات بین مولکولی . برهمکنش های بین مولکولی نوعی برهمکنش بین اتم های خنثی است که در آن هیچ پیوند کووالانسی جدیدی ظاهر نمی شود. نیروهای برهمکنش بین مولکول ها توسط ون دروالس در سال 1869 کشف شد و به نام او نامگذاری شد. نیروهای وان داروالس. نیروهای ون دروالس به دو دسته تقسیم می شوند گرایش, القاء و پراکنده . انرژی برهمکنش های بین مولکولی بسیار کمتر از انرژی پیوندهای شیمیایی است.
جهت گیری نیروهای جاذبه بین مولکول های قطبی (برهمکنش دوقطبی-دوقطبی) رخ می دهد. این نیروها بین مولکول های قطبی اتفاق می افتد. تعاملات استقرایی برهمکنش بین یک مولکول قطبی و یک مولکول غیر قطبی است. یک مولکول غیرقطبی به دلیل عمل یک مولکول قطبی قطبی می شود که جاذبه الکترواستاتیکی اضافی ایجاد می کند.
نوع خاصی از برهمکنش بین مولکولی پیوندهای هیدروژنی است. - اینها پیوندهای شیمیایی بین مولکولی (یا درون مولکولی) هستند که بین مولکول هایی که دارای پیوندهای کووالانسی بسیار قطبی هستند ایجاد می شوند - H-F، H-O یا H-N. اگر چنین پیوندهایی در یک مولکول وجود داشته باشد، بین مولکول ها وجود خواهد داشت نیروهای جذاب اضافی .
مکانیسم آموزش پیوند هیدروژنی تا حدی الکترواستاتیک و تا حدی گیرنده دهنده است. در این حالت دهنده جفت الکترون اتم یک عنصر شدیداً الکترونگاتیو (F, O, N) است و گیرنده اتم های هیدروژن متصل به این اتم ها است. پیوندهای هیدروژنی توسط تمرکز در فضا و اشباع
پیوندهای هیدروژنی را می توان با نقطه نشان داد: H ··· O. هرچه الکترونگاتیوی اتم متصل به هیدروژن بیشتر باشد و اندازه آن کوچکتر باشد، پیوند هیدروژنی قوی تر است. در درجه اول برای اتصالات معمولی است فلوئور با هیدروژن ، و همچنین به اکسیژن و هیدروژن ، کمتر نیتروژن با هیدروژن .

پیوندهای هیدروژنی بین مواد زیر ایجاد می شود:
— هیدروژن فلوراید HF(گاز، محلول هیدروژن فلوراید در آب - اسید هیدروفلوئوریک)، اب H 2 O (بخار، یخ، آب مایع):
— محلول آمونیاک و آمین های آلی- بین مولکول های آمونیاک و آب؛
— ترکیبات آلی که در آنها پیوند O-H یا N-H وجود دارد: الکل ها، اسیدهای کربوکسیلیک، آمین ها، اسیدهای آمینه، فنل ها، آنیلین و مشتقات آن، پروتئین ها، محلول های کربوهیدرات ها - مونوساکاریدها و دی ساکاریدها.
پیوند هیدروژنی بر خواص فیزیکی و شیمیایی مواد تأثیر می گذارد. بنابراین، جاذبه اضافی بین مولکول ها، جوشاندن مواد را دشوار می کند. مواد دارای پیوند هیدروژنی افزایش غیرعادی نقطه جوش را نشان می دهند.
مثلا به عنوان یک قاعده، با افزایش وزن مولکولی، افزایش در نقطه جوش مواد مشاهده می شود. با این حال، در تعدادی از مواد H 2 O-H 2 S-H 2 Se-H 2 Teما تغییر خطی در نقاط جوش مشاهده نمی کنیم.

یعنی در نقطه جوش آب به طور غیر طبیعی بالاست - همانطور که خط مستقیم به ما نشان می دهد کمتر از -61 درجه سانتیگراد نیست، اما بسیار بیشتر، +100 درجه سانتیگراد. این ناهنجاری با وجود پیوندهای هیدروژنی بین مولکول های آب توضیح داده می شود. بنابراین در شرایط عادی (0-20 درجه سانتیگراد) آب است مایعتوسط حالت فاز
اتصال فلزی. خواص پیوند فلزی
پیوند فلزی یک پیوند شیمیایی است که در اثر حضور الکترونهای نسبتاً آزاد ایجاد میشود. مشخصه هم فلزات خالص و هم آلیاژها و ترکیبات بین فلزی آنهاست.
مکانیزم پیوند فلزی
یون های فلزی مثبت در تمام گره های شبکه کریستالی قرار دارند. بین آنها، الکترون های ظرفیت به طور تصادفی حرکت می کنند، مانند مولکول های گاز، که در طول تشکیل یون ها از اتم ها جدا شده اند. این الکترون ها مانند سیمان عمل می کنند و یون های مثبت را در کنار هم نگه می دارند. در غیر این صورت، شبکه تحت تأثیر نیروهای دافعه بین یون ها متلاشی می شود. در همان زمان، الکترونها توسط یونهای درون شبکه بلوری نگه داشته میشوند و نمیتوانند آن را ترک کنند. نیروهای جفت موضعی یا هدایت شده نیستند. به همین دلیل، در بیشتر موارد اعداد هماهنگی بالا ظاهر می شوند (مثلاً 12 یا 8). هنگامی که دو اتم فلز به هم نزدیک می شوند، اوربیتال ها در پوسته بیرونی آنها روی هم قرار می گیرند و اوربیتال های مولکولی را تشکیل می دهند. اگر اتم سوم نزدیک شود، مدار آن با اوربیتال های دو اتم اول همپوشانی پیدا می کند و در نتیجه اوربیتال مولکولی دیگری ایجاد می شود. هنگامی که اتم های زیادی وجود دارد، تعداد زیادی اوربیتال مولکولی سه بعدی ایجاد می شود که در همه جهات گسترش می یابد. به دلیل همپوشانی اوربیتال های متعدد، الکترون های ظرفیت هر اتم تحت تاثیر اتم های زیادی قرار می گیرند.
شبکه های کریستالی مشخصه
بیشتر فلزات یکی از شبکههای بسیار متقارن زیر را با بستهبندی نزدیک اتمها تشکیل میدهند: مکعب مرکز بدن، مکعب وجه در مرکز و شش ضلعی.
در یک شبکه مکعبی (bcc) با مرکز جسم، اتم ها در راس مکعب و یک اتم در مرکز حجم مکعب قرار دارند. فلزات دارای یک شبکه مکعبی در مرکز بدن هستند: Pb، K، Na، Li، β-Ti، β-Zr، Ta، W، V، α-Fe، Cr، Nb، Ba و غیره.
در یک شبکه مکعبی وجهی (fcc)، اتم ها در راس مکعب و در مرکز هر وجه قرار دارند. فلزات این نوع دارای شبکه هستند: α-Ca، Ce، α-Sr، Pb، Ni، Ag، Au، Pd، Pt، Rh، γ-Fe، Cu، α-Co و غیره.
در شبکه شش ضلعی، اتم ها در راس و مرکز پایه های شش ضلعی منشور قرار دارند و سه اتم در صفحه وسط منشور قرار دارند. فلزات دارای این بسته بندی اتم ها هستند: Mg، α-Ti، Cd، Re، Os، Ru، Zn، β-Co، Be، β-Ca و غیره.
سایر خواص
الکترونهایی که آزادانه حرکت میکنند باعث هدایت الکتریکی و گرمایی بالایی میشوند. موادی که دارای پیوند فلزی هستند اغلب استحکام را با انعطاف پذیری ترکیب می کنند، زیرا وقتی اتم ها نسبت به یکدیگر جابجا می شوند، پیوندها شکسته نمی شوند. یکی دیگر از خواص مهم، معطر بودن فلز است.
فلزات گرما و الکتریسیته را به خوبی هدایت می کنند، به اندازه کافی قوی هستند و می توانند بدون تخریب تغییر شکل دهند. برخی از فلزات چکش خوار هستند (می توان آنها را جعل کرد)، برخی دیگر چکش خوار هستند (می توانید از آنها سیم بکشید). این ویژگیهای منحصر به فرد با نوع خاصی از پیوند شیمیایی توضیح داده میشود که اتمهای فلز را به یکدیگر متصل میکند - یک پیوند فلزی.
فلزات در حالت جامد به شکل کریستال های یون های مثبت وجود دارند که گویی در دریایی از الکترون ها که آزادانه بین آنها حرکت می کنند "شناور" هستند.
پیوند فلزی خواص فلزات، به ویژه استحکام آنها را توضیح می دهد. تحت تأثیر نیروی تغییر شکل، یک شبکه فلزی برخلاف کریستال های یونی می تواند بدون ترک خوردن شکل خود را تغییر دهد.
رسانایی حرارتی بالای فلزات با این واقعیت توضیح داده می شود که اگر یک قطعه فلز در یک طرف گرم شود، انرژی جنبشی الکترون ها افزایش می یابد. این افزایش انرژی در "دریای الکترونی" در سراسر نمونه با سرعت بالا پخش می شود.
رسانایی الکتریکی فلزات نیز مشخص می شود. اگر اختلاف پتانسیل به انتهای یک نمونه فلزی اعمال شود، ابر الکترونهای غیرمکانیشده در جهت پتانسیل مثبت جابهجا میشوند: این جریان الکترونهایی که در یک جهت حرکت میکنند، جریان الکتریکی آشنا را نشان میدهد.
اتصال فلزی. خواص پیوند فلزی - مفهوم و انواع طبقه بندی و ویژگی های رده "پیوند فلزی. خواص پیوند فلزی." 2017، 2018.