Iónová väzba
(boli použité materiály zo stránky http://www.hemi.nsu.ru/ucheb138.htm)
K iónovej väzbe dochádza prostredníctvom elektrostatickej príťažlivosti medzi opačne nabitými iónmi. Tieto ióny vznikajú ako výsledok prenosu elektrónov z jedného atómu na druhý. Iónová väzba sa vytvára medzi atómami, ktoré majú veľké rozdiely v elektronegativite (zvyčajne väčšie ako 1,7 na Paulingovej stupnici), napríklad medzi atómami alkalického kovu a atómami halogénu.
Uvažujme o výskyte iónovej väzby na príklade tvorby NaCl.
Z elektronických vzorcov atómov
Na 1s 2 2s 2 2p 6 3s 1 a
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Je vidieť, že na dokončenie vonkajšej úrovne je pre atóm sodíka jednoduchšie vzdať sa jedného elektrónu ako získať sedem a pre atóm chlóru je ľahšie získať jeden elektrón ako získať sedem. Pri chemických reakciách sa atóm sodíka vzdá jedného elektrónu a atóm chlóru ho odoberie. V dôsledku toho sa elektrónové obaly atómov sodíka a chlóru premenia na stabilné elektrónové obaly vzácnych plynov (elektronická konfigurácia katiónu sodíka
Na + 1s 2 2s 2 2p 6,
a elektronická konfigurácia aniónu chlóru je
Cl – - 1s 2 2s 2 2p 6 3s 2 3p 6).
Elektrostatická interakcia iónov vedie k vytvoreniu molekuly NaCl.
Povaha chemickej väzby sa často odráža v stave agregácie a fyzikálnych vlastnostiach látky. Iónové zlúčeniny, ako je chlorid sodný NaCl, sú tvrdé a žiaruvzdorné, pretože medzi nábojmi ich iónov „+“ a „–“ sú silné elektrostatické príťažlivé sily.
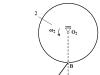
Záporne nabitý ión chlóru priťahuje nielen „svoj“ ión Na+, ale aj ďalšie sodíkové ióny okolo seba. To vedie k tomu, že v blízkosti žiadneho z iónov nie je jeden ión s opačným znamienkom, ale niekoľko.
Štruktúra kryštálu chloridu sodného NaCl.
V skutočnosti je okolo každého iónu chlóru 6 iónov sodíka a okolo každého iónu sodíka 6 iónov chlóru. Toto usporiadané balenie iónov sa nazýva iónový kryštál. Ak je v kryštáli izolovaný jediný atóm chlóru, potom medzi atómami sodíka, ktoré ho obklopujú, už nie je možné nájsť ten, s ktorým chlór reagoval.
Ióny, ktoré sú navzájom priťahované elektrostatickými silami, sú extrémne neochotné meniť svoje umiestnenie pod vplyvom vonkajšej sily alebo zvýšenia teploty. Ak sa však chlorid sodný roztopí a pokračuje v zahrievaní vo vákuu, odparí sa a vytvorí dvojatómové molekuly NaCl. To naznačuje, že kovalentné väzbové sily nie sú nikdy úplne vypnuté.
Základná charakteristika iónových väzieb a vlastnosti iónových zlúčenín
1. Iónová väzba je silná chemická väzba. Energia tejto väzby je rádovo 300 – 700 kJ/mol.
2. Na rozdiel od kovalentnej väzby je iónová väzba nesmerová, pretože ión môže priťahovať ióny opačného znamienka k sebe v akomkoľvek smere.
3. Na rozdiel od kovalentnej väzby je iónová väzba nenasýtená, keďže interakcia iónov opačného znamienka nevedie k úplnej vzájomnej kompenzácii ich silových polí.
4. Pri tvorbe molekúl s iónovou väzbou nedochádza k úplnému prenosu elektrónov, preto stopercentné iónové väzby v prírode neexistujú. V molekule NaCl je chemická väzba iba 80% iónová.
5. Zlúčeniny s iónovými väzbami sú kryštalické pevné látky, ktoré majú vysoké teploty topenia a varu.
6. Väčšina iónových zlúčenín je rozpustná vo vode. Roztoky a taveniny iónových zlúčenín vedú elektrický prúd.
Kovové spojenie
Kovové kryštály majú odlišnú štruktúru. Ak preskúmate kúsok kovového sodíka, zistíte, že jeho vzhľad je veľmi odlišný od kuchynskej soli. Sodík je mäkký kov, ľahko sa krája nožom, splošťuje kladivom, dá sa ľahko roztaviť v pohári na liehovej lampe (teplota topenia 97,8 o C). V kryštáli sodíka je každý atóm obklopený ôsmimi ďalšími podobnými atómami.

Kryštalická štruktúra kovového Na.
Obrázok ukazuje, že atóm Na v strede kocky má 8 najbližších susedov. To isté sa však dá povedať o akomkoľvek inom atóme v kryštáli, pretože všetky sú rovnaké. Kryštál pozostáva z „nekonečne“ sa opakujúcich fragmentov znázornených na tomto obrázku.
Atómy kovu na vonkajšej energetickej úrovni obsahujú malý počet valenčných elektrónov. Pretože ionizačná energia atómov kovov je nízka, valenčné elektróny sú v týchto atómoch slabo zadržané. V dôsledku toho sa v kryštálovej mriežke kovov objavujú kladne nabité ióny a voľné elektróny. V tomto prípade sú kovové katióny umiestnené v uzloch kryštálovej mriežky a elektróny sa voľne pohybujú v poli kladných centier a tvoria takzvaný „elektrónový plyn“.
Prítomnosť záporne nabitého elektrónu medzi dvoma katiónmi spôsobuje, že každý katión interaguje s týmto elektrónom.
teda Kovová väzba je väzba medzi kladnými iónmi v kovových kryštáloch, ku ktorej dochádza prostredníctvom príťažlivosti elektrónov, ktoré sa voľne pohybujú v kryštáli.
Pretože valenčné elektróny v kove sú rovnomerne rozložené v kryštáli, kovová väzba, podobne ako iónová väzba, je nesmerová väzba. Na rozdiel od kovalentnej väzby je kovová väzba nenasýtenou väzbou. Kovová väzba sa tiež líši od kovalentnej väzby v sile. Energia kovovej väzby je približne tri až štyrikrát menšia ako energia kovalentnej väzby.
Vďaka vysokej pohyblivosti elektrónového plynu sa kovy vyznačujú vysokou elektrickou a tepelnou vodivosťou.
Kovový kryštál vyzerá celkom jednoducho, ale v skutočnosti je jeho elektronická štruktúra zložitejšia ako štruktúra kryštálov iónovej soli. Vo vonkajšom elektrónovom obale kovových prvkov nie je dostatok elektrónov na vytvorenie plnohodnotnej „oktetovej“ kovalentnej alebo iónovej väzby. Preto v plynnom stave väčšina kovov pozostáva z monatomických molekúl (t. j. jednotlivých atómov, ktoré nie sú navzájom spojené). Typickým príkladom sú ortuťové výpary. Kovová väzba medzi atómami kovu sa teda vyskytuje iba v kvapalnom a pevnom stave agregácie.
Kovovú väzbu možno opísať takto: niektoré atómy kovu vo výslednom kryštáli odovzdajú svoje valenčné elektróny priestoru medzi atómami (pre sodík je to...3s1) a premenia sa na ióny. Pretože všetky atómy kovu v kryštáli sú rovnaké, každý z nich má rovnakú šancu stratiť valenčný elektrón.
Inými slovami, k prenosu elektrónov medzi neutrálnymi a ionizovanými atómami kovu dochádza bez spotreby energie. V tomto prípade niektoré elektróny vždy skončia v priestore medzi atómami vo forme „elektrónového plynu“.
Tieto voľné elektróny po prvé držia atómy kovu v určitej rovnovážnej vzdialenosti od seba.
Po druhé, dávajú kovom charakteristický „kovový lesk“ (voľné elektróny môžu interagovať so svetelnými kvantami).
Po tretie, voľné elektróny poskytujú kovom dobrú elektrickú vodivosť. Vysoká tepelná vodivosť kovov sa vysvetľuje aj prítomnosťou voľných elektrónov v medziatómovom priestore - ľahko „reagujú“ na zmeny energie a prispievajú k jej rýchlemu prenosu v kryštáli.

Zjednodušený model elektrónovej štruktúry kovového kryštálu.
******** Na príklade kovu sodíka uvažujme o povahe kovovej väzby z hľadiska predstáv o atómových orbitáloch. Atóm sodíka, rovnako ako mnoho iných kovov, má nedostatok valenčných elektrónov, ale existujú voľné valenčné orbitály. Jediný 3s elektrón sodíka je schopný presunúť sa na ktorýkoľvek z voľných a energeticky blízkych susedných orbitálov. Keď sa atómy v kryštáli približujú k sebe, vonkajšie orbitály susedných atómov sa prekrývajú, čo umožňuje uvoľneným elektrónom voľne sa pohybovať po kryštáli.
„Elektrónový plyn“ však nie je taký neusporiadaný, ako by sa mohlo zdať. Voľné elektróny v kovovom kryštáli sú v prekrývajúcich sa orbitáloch a sú do určitej miery zdieľané, čím vytvárajú niečo ako kovalentné väzby. Sodík, draslík, rubídium a iné kovové s-prvky majú jednoducho málo zdieľaných elektrónov, takže ich kryštály sú krehké a taviteľné. So zvyšujúcim sa počtom valenčných elektrónov sa vo všeobecnosti zvyšuje sila kovov.
Kovové väzby teda bývajú tvorené prvkami, ktorých atómy majú vo svojich vonkajších obaloch málo valenčných elektrónov. Tieto valenčné elektróny, ktoré uskutočňujú kovovú väzbu, sú zdieľané natoľko, že sa môžu pohybovať celým kovovým kryštálom a poskytovať vysokú elektrickú vodivosť kovu.
Kryštál NaCl nevedie elektrinu, pretože v priestore medzi iónmi nie sú žiadne voľné elektróny. Všetky elektróny darované atómami sodíka sú pevne držané iónmi chlóru. Toto je jeden z významných rozdielov medzi iónovými kryštálmi a kovovými.
To, čo teraz viete o spájaní kovov, pomáha vysvetliť vysokú kujnosť (ťažnosť) väčšiny kovov. Kov môže byť sploštený do tenkého plechu a ťahaný do drôtu. Faktom je, že jednotlivé vrstvy atómov v kovovom kryštáli sa môžu po sebe pomerne ľahko kĺzať: pohyblivý „elektrónový plyn“ neustále zmäkčuje pohyb jednotlivých kladných iónov a navzájom ich chráni.
Samozrejme, nič také sa nedá robiť s kuchynskou soľou, hoci soľ je tiež kryštalická látka. V iónových kryštáloch sú valenčné elektróny pevne viazané na jadro atómu. Posun jednej vrstvy iónov voči druhej približuje ióny rovnakého náboja k sebe a spôsobuje medzi nimi silné odpudzovanie, čo vedie k deštrukcii kryštálu (NaCl je krehká látka).

Posun vrstiev iónového kryštálu spôsobuje vznik veľkých odpudivých síl medzi podobnými iónmi a deštrukciu kryštálu.
Navigácia
- Riešenie kombinovaných problémov na základe kvantitatívnych charakteristík látky
- Riešenie problémov. Zákon stálosti zloženia látok. Výpočty využívajúce pojmy „molárna hmotnosť“ a „chemické množstvo“ látky
Účel lekcie
- Uveďte predstavu o chemickej väzbe kovov.
- Naučte sa zapisovať vzory tvorby kovových väzieb.
- Zoznámte sa s fyzikálnymi vlastnosťami kovov.
- Naučte sa jasne rozlišovať medzi jednotlivými druhmi chemické väzby .
Ciele lekcie
- Zistite, ako sa navzájom ovplyvňujú atómy kovov
- Určte, ako kovová väzba ovplyvňuje vlastnosti látok, ktoré tvorí
Kľúčové pojmy:
- Elektronegativita - chemická vlastnosť atómu, čo je kvantitatívna charakteristika schopnosti atómu v molekule priťahovať spoločné elektrónové páry.
- Chemická väzba -fenomén interakcie atómov v dôsledku prekrývania elektrónových oblakov interagujúcich atómov.
- Kovové spojenie je väzba v kovoch medzi atómami a iónmi, ktorá vzniká zdieľaním elektrónov.
- Kovalentná väzba - chemická väzba, ktorá vzniká prekrytím dvojice valenčných elektrónov. Elektróny, ktoré poskytujú spojenie, sa nazývajú spoločný elektrónový pár. Existujú 2 typy: polárne a nepolárne.
- Iónová väzba - chemická väzba, ktorá vzniká medzi nekovovými atómami, pri ktorej zdieľaný elektrónový pár prechádza k atómu s vyššou elektronegativitou. V dôsledku toho sa atómy priťahujú ako opačne nabité telesá.
- Vodíková väzba
- chemická väzba medzi elektronegatívnym atómom a atómom vodíka H viazaná kovalentne na iný elektronegatívny atóm. Elektronegatívne atómy môžu byť N, O alebo F. Vodíkové väzby môžu byť intermolekulárne alebo intramolekulárne.
POČAS VYUČOVANIA
Chemická väzba kovov
Identifikujte prvky, ktoré sú v nesprávnom „poradí.“ Prečo?
Ca Fe P K Al Mg Na
Ktoré prvky z tabuľky Mendelejev sa volajú kovy?
Dnes sa dozvieme, aké vlastnosti majú kovy a ako závisia od väzby, ktorá sa vytvára medzi kovovými iónmi.
Najprv si spomeňme na umiestnenie kovov v periodickej tabuľke?
Kovy, ako všetci vieme, zvyčajne neexistujú vo forme izolovaných atómov, ale vo forme kusu, ingotu alebo kovového produktu. Poďme zistiť, čo zhromažďuje atómy kovov v úplnom objeme.
V príklade vidíme kúsok zlata. A mimochodom, zlato je jedinečný kov. Pomocou kovania možno z čistého zlata vyrobiť fóliu s hrúbkou 0,002 mm! Táto tenká fólia je takmer priehľadná a na svetle má zelený odtieň. Výsledkom je, že zo zlatého ingotu veľkosti zápalkovej škatuľky získate tenkú fóliu, ktorá pokryje plochu tenisového kurtu.
Chemicky sa všetky kovy vyznačujú ľahkosťou vzdania sa valenčných elektrónov a v dôsledku toho sa vytvárajú kladne nabité ióny a vykazujú iba pozitívnu oxidáciu. Preto sú kovy vo voľnom stave redukčnými činidlami. Spoločným znakom atómov kovov je ich veľká veľkosť v porovnaní s nekovmi. Vonkajšie elektróny sa nachádzajú vo veľkých vzdialenostiach od jadra, a preto sú s ním slabo spojené, preto sa ľahko oddeľujú.
Atómy väčšieho počtu kovov na vonkajšej úrovni majú malý počet elektrónov - 1,2,3. Tieto elektróny sa ľahko odstránia a atómy kovu sa stanú iónmi.
Ме0 – n ē ⇆ Muži+
atómy kovov – elektróny ext. obieha ⇆ ióny kovov
Týmto spôsobom sa môžu oddelené elektróny pohybovať z jedného iónu na druhý, to znamená, že sa stávajú voľnými, akoby ich spájali do jedného celku. Preto sa ukazuje, že všetky oddelené elektróny sú spoločné, pretože nie je možné pochopiť ktorý elektrón patrí ktorému z atómov kovu.
Elektróny sa môžu spájať s katiónmi, potom sa dočasne vytvoria atómy, z ktorých sa potom odtrhnú elektróny. Tento proces prebieha neustále a bez zastavenia. Ukazuje sa, že v objeme kovu sa atómy nepretržite premieňajú na ióny a naopak. V tomto prípade malý počet zdieľaných elektrónov viaže veľké množstvo atómov kovov a iónov. Je však dôležité, aby sa počet elektrónov v kove rovnal celkovému náboju kladných iónov, to znamená, že vo všeobecnosti kov zostáva elektricky neutrálny.
Tento proces je prezentovaný ako model - kovové ióny sú v oblaku elektrónov. Takýto elektrónový oblak sa nazýva „elektrónový plyn“.
Napríklad na tomto obrázku vidíme, ako sa elektróny pohybujú medzi nehybnými iónmi vo vnútri kryštálovej mriežky kovu. 
Ryža. 2. Pohyb elektrónov
Aby sme lepšie pochopili, čo je elektrónový plyn a ako sa správa pri chemických reakciách rôznych kovov, pozrime si zaujímavé video. (Zlato je v tomto videu spomenuté len ako farba!)
Teraz si môžeme zapísať definíciu: kovová väzba je väzba v kovoch medzi atómami a iónmi, vytvorená zdieľaním elektrónov.
Porovnajme všetky typy spojení, ktoré poznáme, a upevnime ich, aby sme ich lepšie rozlíšili, preto si pozrieme video.
Kovová väzba sa vyskytuje nielen v čistých kovoch, ale je charakteristická aj pre zmesi rôznych kovov a zliatin v rôznych stavoch agregácie.
Kovová väzba je dôležitá a určuje základné vlastnosti kovov
- elektrická vodivosť – náhodný pohyb elektrónov v objeme kovu. Ale s malým rozdielom potenciálov, aby sa elektróny pohybovali usporiadaným spôsobom. Kovy s najlepšou vodivosťou sú Ag, Cu, Au, Al.
- plasticita
Väzby medzi kovovými vrstvami nie sú veľmi významné, to umožňuje vrstvám pohybovať sa pri zaťažení (deformovať kov bez jeho porušenia). Najlepšie deformovateľné kovy (mäkké) sú Au, Ag, Cu.
- kovový lesk
Elektrónový plyn odráža takmer všetky svetelné lúče. Čisté kovy sa preto tak lesknú a najčastejšie majú sivú alebo bielu farbu. Kovy, ktoré sú najlepšími reflektormi Ag, Cu, Al, Pd, Hg
Domáca úloha
Cvičenie 1
Vyberte vzorce látok, ktoré majú
a) kovalentná polárna väzba: Cl2, KCl, NH3, O2, MgO, CCI4, S02;
b) s iónovou väzbou: HCl, KBr, P4, H2S, Na2O, CO2, CaS.
Cvičenie 2
Prečiarknite extra:
a) CuCl2, Al, MgS
b) N2, HCl, O2
c) Ca, CO2, Fe
d) MgCl2, NH3, H2
Kovový sodík, lítium a iné alkalické kovy menia farbu plameňa. Kovové lítium a jeho soli dávajú ohňu červenú farbu, kovové sodné a sodné soli mu dávajú žltú farbu, kovové draslík a jeho soli fialovú farbu a rubídium a cézium fialovú farbu, ale svetlejšiu.
Ryža. 4. Kúsok lítiového kovu 
Ryža. 5. Plameňové farbenie s kovmi
Lítium (Li). Lítium, podobne ako sodík, je alkalický kov. Obe sú rozpustné vo vode. Sodík po rozpustení vo vode vytvára lúh sodný, veľmi silnú kyselinu. Keď sa alkalické kovy rozpustia vo vode, uvoľní sa veľa tepla a plynu (vodík). Je vhodné, aby ste sa takýchto kovov nedotýkali rukami, mohli by ste sa popáliť.
Bibliografia
1. Lekcia na tému „Kovová chemická väzba“, učiteľ chémie Tukhta Valentina Anatolyevna MOU „Yesenovichskaya Secondary School“
2. F. A. Derkach „Chémia“ - vedecká a metodická príručka. – Kyjev, 2008.
3. L. B. Tsvetkova „Anorganická chémia“ - 2. vydanie, opravené a rozšírené. – Ľvov, 2006.
4. V. V. Malinovsky, P. G. Nagorny „Anorganická chémia“ - Kyjev, 2009.
5. Glinka N.L. Všeobecná chémia. – 27. vydanie/pod. vyd. V.A. Rabinovič. – L.: Chémia, 2008. – 704 s.
Upravil a poslal Lisnyak A.V.
Na lekcii sa pracovalo:
Tukhta V.A.
Lisnyak A.V.
Môžete položiť otázku o modernom vzdelávaní, vyjadriť myšlienku alebo vyriešiť naliehavý problém na Vzdelávacie fórum, kde sa na medzinárodnej úrovni stretáva vzdelávacia rada nových myšlienok a činov. Po vytvorení blog, Chémia 8. ročník
Kovové spojenie
V dôsledku elektrostatickej príťažlivosti medzi katiónom a aniónom sa vytvorí molekula.
Iónová väzba
Teóriu iónovej väzby navrhol o 1916 ᴦ. Nemecký vedec W. Kossel. Táto teória vysvetľuje vytváranie spojení medzi atómov typických kovov a atómov typický nekovy: CsF, CsCl, NaCl, KF, KCl, Na20 atď.
Podľa tejto teórie, keď sa vytvorí iónová väzba, atómy typických kovov sa vzdávajú elektrónov a atómy typických nekovov elektróny prijímajú.
V dôsledku týchto procesov sa atómy kovov premieňajú na kladne nabité častice, ktoré sa nazývajú kladné ióny alebo katióny; a nekovové atómy sa menia na záporné ióny - anióny. Náboj katiónu sa rovná počtu odovzdaných elektrónov.
Atómy kovov darujú elektróny svojej vonkajšej vrstve a výsledné ióny majú úplné elektronické štruktúry (predvonkajšia elektronická vrstva).
Veľkosť záporného náboja aniónu sa rovná počtu prijatých elektrónov.
Nekovové atómy akceptujú počet elektrónov, ktorý je pre nich mimoriadne dôležitý dokončenie elektronického oktetu (vonkajšia elektronická vrstva).
Napríklad: všeobecná schéma tvorby molekuly NaCl z atómov Na a C1: Na°-le = Na +1 Tvorba iónov
Сl°+1е - = Сl -
Na +1 + Cl - = Na + Cl -
Na°+ Сl°= Na + Сl - Zlúčenina iónov
· Väzba medzi iónmi sa bežne nazýva iónová väzba.
Zlúčeniny, ktoré pozostávajú z iónov, sa nazývajú iónové zlúčeniny.
Algebraický súčet nábojov všetkých iónov v molekule iónovej zlúčeniny sa musí rovnať nule, pretože každá molekula je elektricky neutrálna častica.
Medzi iónovými a kovalentnými väzbami neexistuje ostrá hranica. Iónová väzba môže byť považovaná za extrémny prípad polárnej kovalentnej väzby, pri ktorej vzniká spoločný elektrónový pár úplne sa pohybuje smerom k atómu s vyššou elektronegativitou.
Najtypickejšie atómy kovu majú vo svojej vonkajšej elektrónovej vrstve malý počet elektrónov (zvyčajne 1 až 3); tieto elektróny sa nazývajú valenčné elektróny. V atómoch kovov je sila väzby medzi valenčnými elektrónmi a jadrom nízka, to znamená, že atómy majú nízku ionizačnú energiu. To uľahčuje stratu valenčných elektrónov h premena atómov kovov na kladne nabité ióny (katióny):
Ме° -ne ® Ме n +
V kryštálovej štruktúre kovu majú valenčné elektróny schopnosť ľahko sa pohybovať z jedného atómu na druhý, čo vedie k zdieľaniu elektrónov všetkými susednými atómami. Zjednodušene je štruktúra kovového kryštálu znázornená nasledovne: v uzloch kryštálovej mriežky sú ióny Me n+ a atómy Me° a valenčné elektróny sa medzi nimi pohybujú relatívne voľne a vytvárajú spojenia medzi všetkými atómami a iónmi kov (obr. 3). Ide o špeciálny typ chemickej väzby nazývanej kovová väzba.
· Kovová väzba - väzba medzi atómami a iónmi kovov v kryštálovej mriežke, uskutočňovaná zdieľanými valenčnými elektrónmi.
Vďaka tomuto typu chemickej väzby majú kovy určitý súbor fyzikálnych a chemických vlastností, ktoré ich odlišujú od nekovov.
 Ryža. 3. Schéma kryštálovej mriežky kovov.
Ryža. 3. Schéma kryštálovej mriežky kovov.
Pevnosť kovovej väzby zabezpečuje stabilitu kryštálovej mriežky a plasticitu kovov (schopnosť podstúpiť rôzne spracovanie bez deštrukcie). Voľný pohyb valenčných elektrónov umožňuje kovom dobre viesť elektrinu a teplo. Schopnosť odrážať svetelné vlny (ᴛ.ᴇ. kovový lesk) sa vysvetľuje aj štruktúrou kryštálovej mriežky kovu.
Najcharakteristickejšie fyzikálne vlastnosti kovov založené na prítomnosti kovovej väzby sú však:
■kryštalická štruktúra;
■ kovový lesk a nepriehľadnosť;
■plasticita, kujnosť, tavivosť;
■vysoká elektrická a tepelná vodivosť; a sklon k tvorbe zliatin.
Kovová väzba - pojem a typy. Klasifikácia a vlastnosti kategórie "Kovové spojenie" 2017, 2018.
Samotný názov „kovová väzba“ naznačuje, že hovoríme o vnútornej štruktúre kovov. Atómy väčšiny kovov na vonkajšej energetickej úrovni obsahujú malý počet valenčných elektrónov v porovnaní s celkovým počtom vonkajších, ktoré sú energeticky blízko... .
Kovová väzba je založená na zdieľaní valenčných elektrónov, ktoré nepatria dvom, ale takmer všetkým atómom kovu v kryštáli. V kovoch je oveľa menej valenčných elektrónov ako voľných orbitálov. To vytvára podmienky pre voľný pohyb... .
Základné informácie o povahe chemických väzieb v kovoch možno získať na základe dvoch charakteristických vlastností v porovnaní s kovalentnými a iónovými zlúčeninami. Kovy sa po prvé líšia od iných látok svojou vysokou elektrickou vodivosťou a... .
Významné informácie o povahe chemických väzieb v kovoch možno získať na základe dvoch ich charakteristických vlastností v porovnaní s kovalentnými a iónovými zlúčeninami. Kovy sa po prvé líšia od iných látok svojou vysokou elektrickou vodivosťou a... .
Hybridizácia orbitálov a priestorová konfigurácia molekúl Typ molekuly Počiatočné orbitály atómu A Typ hybridizácie Počet hybridných orbitálov atómu A Priestorová konfigurácia molekuly AB2 AB3 AB4 s + p s + p + p s + p + p + p sp sp2 sp3 ... .
Kovová väzba je chemická väzba spôsobená prítomnosťou relatívne voľných elektrónov. Charakteristické pre čisté kovy a ich zliatiny a intermetalické zlúčeniny. Mechanizmus kovovej väzby Vo všetkých uzloch kryštálovej mriežky sú... .
Molekula je najmenšia častica látky, ktorá má svoje chemické vlastnosti. Podľa teórie chemickej väzby stabilnému stavu prvku zodpovedá štruktúra s elektrónovým vzorcom vonkajšej hladiny s2p6 (argón, kryptón, radón a iné). Počas vzdelávania....
Témy kodifikátora Jednotnej štátnej skúšky: Kovalentná chemická väzba, jej odrody a mechanizmy vzniku. Charakteristika kovalentných väzieb (polarita a väzbová energia). Iónová väzba. Kovové spojenie. Vodíková väzba
Intramolekulárne chemické väzby
Najprv sa pozrime na väzby, ktoré vznikajú medzi časticami v rámci molekúl. Takéto spojenia sú tzv intramolekulárne.
Chemická väzba medzi atómami chemických prvkov má elektrostatickú povahu a vzniká v dôsledku interakcia vonkajších (valenčných) elektrónov vo väčšej či menšej miere držané kladne nabitými jadrami viazané atómy.
Kľúčový koncept je tu ELEKTRONEGATIVITA. Práve to určuje typ chemickej väzby medzi atómami a vlastnosti tejto väzby.
je schopnosť atómu priťahovať (držať) externé(valencia) elektróny. Elektronegativita je určená stupňom priťahovania vonkajších elektrónov k jadru a závisí predovšetkým od polomeru atómu a náboja jadra.
Elektronegativitu je ťažké jednoznačne určiť. L. Pauling zostavil tabuľku relatívnych elektronegativít (na základe väzbových energií dvojatómových molekúl). Najviac elektronegatívnym prvkom je fluór so zmyslom 4 .
Je dôležité poznamenať, že v rôznych zdrojoch môžete nájsť rôzne stupnice a tabuľky hodnôt elektronegativity. Nemalo by sa to znepokojovať, pretože úlohu zohráva tvorba chemickej väzby atómov a je približne rovnaký v každom systéme.
Ak jeden z atómov v chemickej väzbe A:B priťahuje elektróny silnejšie, potom sa elektrónový pár pohybuje smerom k nemu. Viac rozdiel elektronegativity atómov, tým viac sa elektrónový pár posúva.
Ak sú elektronegativity interagujúcich atómov rovnaké alebo približne rovnaké: EO(A)≈EO(B), potom sa spoločný elektrónový pár neposúva k žiadnemu z atómov: A: B. Toto spojenie sa nazýva kovalentné nepolárne.
Ak sa elektronegativity interagujúcich atómov líšia, ale nie veľmi (rozdiel v elektronegativite je približne od 0,4 do 2: 0,4<ΔЭО<2 ), potom sa elektrónový pár premiestni na jeden z atómov. Toto spojenie sa nazýva kovalentná polárna .
Ak sa elektronegativity interagujúcich atómov výrazne líšia (rozdiel v elektronegativite je väčší ako 2: ΔEO>2), potom sa jeden z elektrónov takmer úplne prenesie na iný atóm, pričom sa vytvorí ióny. Toto spojenie sa nazýva iónový.
Základné typy chemických väzieb − kovalentný, iónový A kov komunikácie. Poďme sa na ne pozrieť bližšie.
Kovalentná chemická väzba
Kovalentná väzba – je to chemická väzba , vytvorený kvôli vznik spoločného elektrónového páru A:B . Navyše dva atómy prekrývať atómové orbitály. Kovalentná väzba vzniká interakciou atómov s malým rozdielom v elektronegativite (zvyčajne medzi dvoma nekovmi) alebo atómy jedného prvku.
Základné vlastnosti kovalentných väzieb
- zameranie,
- sýtosť,
- polarita,
- polarizovateľnosť.
Tieto väzbové vlastnosti ovplyvňujú chemické a fyzikálne vlastnosti látok.
Smer komunikácie charakterizuje chemickú štruktúru a formu látok. Uhly medzi dvoma väzbami sa nazývajú väzbové uhly. Napríklad v molekule vody je väzbový uhol H-O-H 104,45 o, preto je molekula vody polárna a v molekule metánu je väzbový uhol H-C-H 108 o 28′.

Sýtosť je schopnosť atómov tvoriť obmedzený počet kovalentných chemických väzieb. Počet väzieb, ktoré môže atóm vytvoriť, sa nazýva.
Polarita k väzbe dochádza v dôsledku nerovnomerného rozloženia hustoty elektrónov medzi dvoma atómami s rôznou elektronegativitou. Kovalentné väzby sa delia na polárne a nepolárne.
Polarizovateľnosť spojenia sú schopnosť väzbových elektrónov posúvať sa vplyvom vonkajšieho elektrického poľa(najmä elektrické pole inej častice). Polarizácia závisí od mobility elektrónov. Čím ďalej je elektrón od jadra, tým je mobilnejší, a preto je molekula polarizovateľnejšia.

Kovalentná nepolárna chemická väzba
Existujú 2 typy kovalentných väzieb - POLAR A NEPOLÁRNY .
Príklad . Uvažujme o štruktúre molekuly vodíka H2. Každý atóm vodíka vo svojej vonkajšej energetickej hladine nesie 1 nepárový elektrón. Na zobrazenie atómu používame Lewisovu štruktúru - ide o schému štruktúry vonkajšej energetickej hladiny atómu, keď sú elektróny označené bodkami. Lewisove modely bodovej štruktúry sú veľmi užitočné pri práci s prvkami druhej periódy.
H. + . H = H:H
Molekula vodíka má teda jeden spoločný elektrónový pár a jednu chemickú väzbu H–H. Tento elektrónový pár sa neposúva k žiadnemu z atómov vodíka, pretože Atómy vodíka majú rovnakú elektronegativitu. Toto spojenie sa nazýva kovalentné nepolárne .

Kovalentná nepolárna (symetrická) väzba je kovalentná väzba tvorená atómami s rovnakou elektronegativitou (zvyčajne rovnakými nekovmi), a teda s rovnomerným rozložením hustoty elektrónov medzi jadrami atómov.
Dipólový moment nepolárnych väzieb je 0.
Príklady: H2(H-H), 02(0=0), S8.
Kovalentná polárna chemická väzba
Kovalentná polárna väzba je kovalentná väzba, ktorá sa vyskytuje medzi atómy s rôznou elektronegativitou (zvyčajne, rôzne nekovy) a je charakterizovaný posunutie zdieľaný elektrónový pár k viac elektronegatívnemu atómu (polarizácia).
Hustota elektrónov je posunutá k viac elektronegatívnemu atómu - preto sa na ňom objaví čiastočný záporný náboj (δ-) a na menej elektronegatívnom atóme čiastočný kladný náboj (δ+, delta +).
Čím väčší je rozdiel v elektronegativite atómov, tým vyšší polarita pripojenia a ďalšie dipólového momentu . Ďalšie príťažlivé sily pôsobia medzi susednými molekulami a nábojmi opačného znamienka, ktoré sa zvyšuje silu komunikácie.
Polarita väzby ovplyvňuje fyzikálne a chemické vlastnosti zlúčenín. Reakčné mechanizmy a dokonca aj reaktivita susedných väzieb závisia od polarity väzby. Často rozhoduje polarita spojenia polarita molekuly a teda priamo ovplyvňuje také fyzikálne vlastnosti, ako je bod varu a teplota topenia, rozpustnosť v polárnych rozpúšťadlách.
Príklady: HCl, C02, NH3.
Mechanizmy tvorby kovalentnej väzby
Kovalentné chemické väzby môžu vznikať 2 mechanizmami:
1. Výmenný mechanizmus vytvorenie kovalentnej chemickej väzby je, keď každá častica poskytuje jeden nepárový elektrón na vytvorenie spoločného elektrónového páru:
A . + . B = A:B
2. Tvorba kovalentnej väzby je mechanizmus, v ktorom jedna z častíc poskytuje osamelý elektrónový pár a druhá častica poskytuje prázdny orbitál pre tento elektrónový pár:
A: + B = A:B

V tomto prípade jeden z atómov poskytuje osamelý pár elektrónov ( darcu) a druhý atóm poskytuje tomuto páru prázdny orbitál ( akceptor). V dôsledku vzniku oboch väzieb klesá energia elektrónov, t.j. to je prospešné pre atómy.
Kovalentná väzba vytvorená mechanizmom donor-akceptor nie je iný vo vlastnostiach z iných kovalentných väzieb vytvorených výmenným mechanizmom. Vznik kovalentnej väzby mechanizmom donor-akceptor je typický pre atómy buď s veľkým počtom elektrónov na vonkajšej energetickej úrovni (donory elektrónov), alebo naopak s veľmi malým počtom elektrónov (akceptory elektrónov). Valenčné schopnosti atómov sú podrobnejšie diskutované v príslušnej časti.
Kovalentná väzba vzniká mechanizmom donor-akceptor:
- v molekule oxid uhoľnatý CO(väzba v molekule je trojitá, 2 väzby vznikajú mechanizmom výmeny, jedna mechanizmom donor-akceptor): C≡O;
- V amónny ión NH4+, v iónoch organické amíny napríklad v metylamóniovom ióne CH3-NH2+;
- V komplexné zlúčeniny chemická väzba medzi centrálnym atómom a ligandovými skupinami, napríklad v tetrahydroxohlinitane sodnom, Na väzbe medzi iónmi hliníka a hydroxidu;
- V kyselina dusičná a jej soli- dusičnany: HNO 3, NaNO 3, v niektorých ďalších zlúčeninách dusíka;

- v molekule ozón O3.
Základné charakteristiky kovalentných väzieb
Kovalentné väzby sa typicky tvoria medzi nekovovými atómami. Hlavnými charakteristikami kovalentnej väzby sú dĺžka, energia, multiplicita a smerovosť.
Mnohonásobnosť chemickej väzby
Mnohonásobnosť chemickej väzby - Toto počet zdieľaných elektrónových párov medzi dvoma atómami v zlúčenine. Mnohopočetnosť väzby sa dá pomerne ľahko určiť z hodnôt atómov, ktoré tvoria molekulu.
Napríklad , v molekule vodíka H 2 je väzbová násobnosť 1, pretože Každý vodík má na svojej vonkajšej energetickej úrovni iba 1 nepárový elektrón, preto sa vytvorí jeden zdieľaný elektrónový pár.
V molekule kyslíka O 2 je väzbová multiplicita 2, pretože Každý atóm na vonkajšej energetickej úrovni má 2 nepárové elektróny: O=O.
V molekule dusíka N2 je väzbová multiplicita 3, pretože medzi každým atómom sú 3 nepárové elektróny na vonkajšej energetickej úrovni a atómy tvoria 3 spoločné elektrónové páry N≡N.
Dĺžka kovalentnej väzby
Dĺžka chemickej väzby
je vzdialenosť medzi stredmi jadier atómov tvoriacich väzbu. Stanovuje sa experimentálnymi fyzikálnymi metódami. Dĺžku väzby možno približne odhadnúť pomocou pravidla aditivity, podľa ktorého sa dĺžka väzby v molekule AB približne rovná polovici súčtu dĺžok väzieb v molekulách A 2 a B 2: 
Dĺžku chemickej väzby možno približne odhadnúť atómovými polomermi vytvorenie väzby, príp komunikačnou multiplicitou, ak polomery atómov nie sú veľmi odlišné.
Keď sa polomery atómov tvoriacich väzbu zväčšujú, dĺžka väzby sa zväčšuje.
Napríklad
S rastúcim počtom väzieb medzi atómami (ktorých atómové polomery sa nelíšia alebo sa líšia len nepatrne) sa dĺžka väzby zmenšuje.
Napríklad . V sérii: C–C, C=C, C≡C sa dĺžka väzby zmenšuje.
Komunikačná energia
Meradlom sily chemickej väzby je energia väzby. Komunikačná energia určená energiou potrebnou na prerušenie väzby a odstránenie atómov tvoriacich túto väzbu do nekonečne veľkej vzdialenosti od seba.
Kovalentná väzba je veľmi odolný. Jeho energia sa pohybuje od niekoľkých desiatok do niekoľkých stoviek kJ/mol. Čím vyššia je energia väzby, tým väčšia je pevnosť väzby a naopak.
Sila chemickej väzby závisí od dĺžky väzby, polarity väzby a násobnosti väzby. Čím dlhšia je chemická väzba, tým ľahšie sa rozbije a čím nižšia je energia väzby, tým nižšia je jej pevnosť. Čím je chemická väzba kratšia, tým je silnejšia a tým väčšia je energia väzby.
Napríklad, v rade zlúčenín HF, HCl, HBr zľava doprava sila chemickej väzby klesá, pretože Dĺžka spojenia sa zvyšuje.
Iónová chemická väzba

Iónová väzba je chemická väzba založená na elektrostatická príťažlivosť iónov.
Ióny vznikajú v procese prijímania alebo darovania elektrónov atómami. Napríklad atómy všetkých kovov slabo držia elektróny z vonkajšej energetickej hladiny. Preto sa atómy kovov vyznačujú tým obnovovacie vlastnosti- schopnosť darovať elektróny.

Príklad. Atóm sodíka obsahuje 1 elektrón na energetickej úrovni 3. Tým, že sa ho ľahko vzdáva, vytvorí atóm sodíka oveľa stabilnejší ión Na + s elektrónovou konfiguráciou neónu vzácneho plynu Ne. Sodíkový ión obsahuje 11 protónov a iba 10 elektrónov, takže celkový náboj iónu je -10+11 = +1:
+11Na) 2 ) 8 ) 1 - 1e = +11 Na +) 2 ) 8
Príklad. Atóm chlóru vo svojej vonkajšej energetickej úrovni obsahuje 7 elektrónov. Na získanie konfigurácie stabilného inertného atómu argónu Ar potrebuje chlór získať 1 elektrón. Po pridaní elektrónu sa vytvorí stabilný ión chlóru pozostávajúci z elektrónov. Celkový náboj iónu je -1:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Poznámka:
- Vlastnosti iónov sú iné ako vlastnosti atómov!
- Stabilné ióny môžu tvoriť nielen atómov, ale tiež skupiny atómov. Napríklad: amónny ión NH 4 +, síranový ión SO 4 2- atď. Chemické väzby tvorené takýmito iónmi sa tiež považujú za iónové;
- Iónové väzby sa zvyčajne vytvárajú medzi sebou kovy A nekovy(nekovové skupiny);
Výsledné ióny sú priťahované v dôsledku elektrickej príťažlivosti: Na + Cl -, Na 2 + SO 4 2-.
Poďme si to vizuálne zhrnúť rozdiel medzi typmi kovalentnej a iónovej väzby:


Kovové spojenie je spojenie, ktoré sa tvorí relatívne voľné elektróny medzi kovové ióny, tvoriace kryštálovú mriežku.
Atómy kovov sa zvyčajne nachádzajú na vonkajšej energetickej úrovni jeden až tri elektróny. Polomery atómov kovov sú spravidla veľké - preto sa atómy kovov na rozdiel od nekovov celkom ľahko vzdávajú svojich vonkajších elektrónov, t.j. sú silné redukčné činidlá.
Darovaním elektrónov sa atómy kovov premenia na kladne nabité ióny . Oddelené elektróny sú relatívne voľné sa sťahujú medzi kladne nabitými iónmi kovov. Medzi týmito časticami vzniká spojenie, pretože zdieľané elektróny držia kovové katióny usporiadané vo vrstvách pohromade , čím vzniká pomerne silný kovová kryštálová mriežka . V tomto prípade sa elektróny nepretržite pohybujú chaoticky, t.j. Neustále sa objavujú nové neutrálne atómy a nové katióny.

Medzimolekulové interakcie
Samostatne stojí za to zvážiť interakcie, ktoré vznikajú medzi jednotlivými molekulami v látke - medzimolekulové interakcie . Intermolekulové interakcie sú typom interakcie medzi neutrálnymi atómami, v ktorých sa neobjavujú žiadne nové kovalentné väzby. Sily interakcie medzi molekulami objavil Van der Waals v roku 1869 a pomenoval ich po ňom Van dar Waalsove sily. Van der Waalsove sily sa delia na orientácia, indukcia A disperzný . Energia medzimolekulových interakcií je oveľa menšia ako energia chemických väzieb.
Orientačné príťažlivé sily sa vyskytujú medzi polárnymi molekulami (interakcia dipól-dipól). Tieto sily sa vyskytujú medzi polárnymi molekulami. Indukčné interakcie je interakcia medzi polárnou molekulou a nepolárnou molekulou. Nepolárna molekula je polarizovaná v dôsledku pôsobenia polárnej molekuly, ktorá vytvára dodatočnú elektrostatickú príťažlivosť.
Špeciálnym typom medzimolekulovej interakcie sú vodíkové väzby. - sú to intermolekulárne (alebo intramolekulárne) chemické väzby, ktoré vznikajú medzi molekulami, ktoré majú vysoko polárne kovalentné väzby - H-F, H-O alebo H-N. Ak sú v molekule takéto väzby, potom medzi molekulami budú dodatočné príťažlivé sily .
Vzdelávací mechanizmus vodíková väzba je čiastočne elektrostatická a čiastočne donor-akceptorová. V tomto prípade je donorom elektrónového páru atóm silne elektronegatívneho prvku (F, O, N) a akceptorom sú atómy vodíka spojené s týmito atómami. Vodíkové väzby sa vyznačujú zameranie vo vesmíre a nasýtenia
Vodíkové väzby môžu byť označené bodkami: H ··· O. Čím väčšia je elektronegativita atómu spojeného s vodíkom a čím menšia je jeho veľkosť, tým silnejšia je vodíková väzba. Je to typické predovšetkým pre spoje fluór s vodíkom , ako aj do kyslík a vodík , menej dusík s vodíkom .

Vodíkové väzby sa vyskytujú medzi týmito látkami:
— fluorovodík HF(plyn, roztok fluorovodíka vo vode - kyselina fluorovodíková), voda H2O (para, ľad, tekutá voda):
— roztok amoniaku a organických amínov- medzi molekulami amoniaku a vody;
— organické zlúčeniny, v ktorých sa viaže O-H alebo N-H: alkoholy, karboxylové kyseliny, amíny, aminokyseliny, fenoly, anilín a jeho deriváty, bielkoviny, roztoky sacharidov - monosacharidy a disacharidy.
Vodíková väzba ovplyvňuje fyzikálne a chemické vlastnosti látok. Dodatočná príťažlivosť medzi molekulami teda sťažuje varenie látok. Látky s vodíkovými väzbami vykazujú abnormálny nárast teploty varu.
Napríklad Spravidla sa so zvyšujúcou sa molekulovou hmotnosťou pozoruje zvýšenie teploty varu látok. Avšak v množstve látok H20-H2S-H2Se-H2Te nepozorujeme lineárnu zmenu bodov varu.

Totiž pri bod varu vody je abnormálne vysoký - nie menej ako -61 o C, ako nám ukazuje priamka, ale oveľa viac, +100 o C. Táto anomália sa vysvetľuje prítomnosťou vodíkových väzieb medzi molekulami vody. Preto za normálnych podmienok (0-20 o C) voda je kvapalina podľa fázového stavu.
Kovové spojenie. Vlastnosti kovovej väzby.
Kovová väzba je chemická väzba spôsobená prítomnosťou relatívne voľných elektrónov. Charakteristické pre čisté kovy a ich zliatiny a intermetalické zlúčeniny.
Kovový spojovací mechanizmus
Pozitívne kovové ióny sa nachádzajú vo všetkých uzloch kryštálovej mriežky. Medzi nimi sa valenčné elektróny pohybujú náhodne, podobne ako molekuly plynu, oddelené od atómov pri tvorbe iónov. Tieto elektróny pôsobia ako cement a držia kladné ióny pohromade; inak by sa mriežka vplyvom odpudivých síl medzi iónmi rozpadla. Elektróny sú zároveň držané iónmi v kryštálovej mriežke a nemôžu ju opustiť. Spojovacie sily nie sú lokalizované ani usmernené. Z tohto dôvodu sa vo väčšine prípadov objavujú vysoké koordinačné čísla (napríklad 12 alebo 8). Keď sa dva atómy kovu priblížia k sebe, orbitály v ich vonkajších obaloch sa prekrývajú a vytvárajú molekulárne orbitály. Ak sa približuje tretí atóm, jeho orbitál sa prekrýva s orbitálmi prvých dvoch atómov, čo vedie k ďalšiemu molekulovému orbitálu. Keď je veľa atómov, vzniká obrovské množstvo trojrozmerných molekulových orbitálov, ktoré sa rozprestierajú všetkými smermi. V dôsledku viacerých prekrývajúcich sa orbitálov sú valenčné elektróny každého atómu ovplyvnené mnohými atómami.
Charakteristické kryštálové mriežky
Väčšina kovov tvorí jednu z nasledujúcich vysoko symetrických mriežok s tesným usporiadaním atómov: kubická centrovaná na telo, kubická centrovaná tvárou a šesťuholníková.
V kubickej (bcc) mriežke so stredom tela sú atómy umiestnené vo vrcholoch kocky a jeden atóm je v strede objemu kocky. Kovy majú kubickú telesne centrovanú mriežku: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba atď.
V plošne centrovanej kubickej (fcc) mriežke sú atómy umiestnené vo vrcholoch kocky a v strede každej steny. Kovy tohto typu majú mriežku: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co atď.
V šesťuholníkovej mriežke sú atómy umiestnené vo vrcholoch a strede šesťuholníkových základov hranola a tri atómy sú umiestnené v strednej rovine hranola. Kovy majú toto balenie atómov: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca atď.
Iné vlastnosti
Voľne sa pohybujúce elektróny spôsobujú vysokú elektrickú a tepelnú vodivosť. Látky, ktoré majú kovovú väzbu, často spájajú pevnosť s plasticitou, pretože keď sa atómy navzájom premiestnia, väzby sa nerozbijú. Ďalšou dôležitou vlastnosťou je kovová aromatickosť.
Kovy dobre vedú teplo a elektrinu, sú dostatočne pevné a môžu sa deformovať bez zničenia. Niektoré kovy sú kujné (dajú sa kovať), niektoré sú kujné (dá sa z nich ťahať drôt). Tieto jedinečné vlastnosti sú vysvetlené špeciálnym typom chemickej väzby, ktorá spája atómy kovov navzájom - kovovou väzbou.
Kovy v pevnom stave existujú vo forme kryštálov kladných iónov, akoby „plávali“ v mori elektrónov, ktoré sa medzi nimi voľne pohybujú.
Kovová väzba vysvetľuje vlastnosti kovov, najmä ich pevnosť. Pod vplyvom deformujúcej sily môže kovová mriežka na rozdiel od iónových kryštálov zmeniť svoj tvar bez praskania.
Vysoká tepelná vodivosť kovov sa vysvetľuje skutočnosťou, že ak sa kus kovu zahreje na jednej strane, kinetická energia elektrónov sa zvýši. Toto zvýšenie energie sa bude šíriť v „elektrónovom mori“ vo vzorke vysokou rýchlosťou.
Vyjasní sa aj elektrická vodivosť kovov. Ak sa na konce kovovej vzorky aplikuje potenciálny rozdiel, oblak delokalizovaných elektrónov sa posunie v smere kladného potenciálu: tento tok elektrónov pohybujúcich sa v jednom smere predstavuje známy elektrický prúd.
Kovové spojenie. Vlastnosti kovovej väzby. - pojem a druhy. Klasifikácia a vlastnosti kategórie "Kovová väzba. Vlastnosti kovovej väzby." 2017, 2018.