a primeira é uma molécula de água, a segunda é uma molécula de dióxido de carbono, a terceira é uma molécula de metano, a quarta é uma molécula de dióxido de enxofre.
Olá, por favor me ajude a resolver o teste 2 de química8 ª série
no tema “Substâncias simples. Quantidade de substância."
Opção 1.
A1. O sinal do elemento que forma uma substância simples – um não metal:
1) Na 2) C 3) K 4) Al
A2. Substância simples – metal:
1) oxigênio 2) cobre 3) fósforo 4) enxofre
A3. O estado físico da substância simples mercúrio em condições normais
condições:
1) sólido 2) líquido 3) gasoso
A4. A ligação química é covalente apolar
na substância:
1) ferro 2) cloro 3) água 4) cobre
A5. Modificação alotrópica do oxigênio:
1) grafite 2) fósforo branco 3) ozônio 4) carvão
A6. A notação 3O2 significa:
1) 2 moléculas de oxigênio
2) 3 moléculas de oxigênio
3) 5 átomos de oxigênio
4) 6 átomos de oxigênio
A7. A massa de 3 moles de sulfeto de hidrogênio H2S é igual a:
1) 33 2) 34 3) 99 4) 102
A8. O volume ocupado por 2 moles de uma substância gasosa com
fórmula SO2 (n.s):
1)22,4 litros. 2) 33,6 litros. 3) 44,8 litros. 4) 67,2 litros.
A9. Um grupo de substâncias com um tipo de ligação química iônica:
1) Cl2, H2, O2 2) KCl, NaBr, CaI2
3) H2O, CO2, NaCl 4) K2O, MgO, NaI
A10. O volume molar é. . .
1) volume de qualquer gás no não. 2) volume de 2 g de qualquer gás a zero
3) volume de 1 mol de qualquer gás no nº 4) volume de 12 * 1023 moléculas no nº.
A11. 3 moléculas de cloro:
1)3Cl2 2)3Cl 3)Cl2 4)6Cl
Q1. Identifique uma substância dura e macia que deixa marcas no papel, tem um leve brilho metálico e é eletricamente condutora:
1) diamante 2) carvão 3) grafite 4) fósforo branco
ÀS 2. O número de moléculas em 2 mmol de água é:
1) 12*1023. 2) 12*1020. 3) 18*1020 4) 12*1018
ÀS 3. Substâncias dispostas em ordem crescente de não metálicas
propriedades:
1) K, Na, Rb, Li 2) Li, Na K, Rb 3) Rb, K, Na, Li 4) Na, Rb, K, Li
C1. Calcule o volume de 140 kg. nitrogênio N2 no não.
A.Na B.C.C.K D.Al
2) Substância simples - metal:
A. oxigênio B. Cobre C. Fósforo D. Enxofre
3) O estado físico da substância simples mercúrio em condições normais:
A. Sólido B. Líquido C. Gasoso
4) A ligação química é covalente apolar em uma substância:
A. Ferro B. Líquido C. Gasoso
5) Modificação alotrópica do oxigênio:
A. Grafite B. Ozônio
B. Fósforo branco D. Diamante
6) Um átomo de um elemento formando uma substância simples - metal, corresponde a um diagrama eletrônico:
A. +18))) B. +3)) C. +6)) D. +15)))
288 21 24 285
7) A entrada ZO2 significa:
A. 2 moléculas de oxigênio
B. 3 moléculas de oxigênio
B. 5 átomos de oxigênio
D. 3 átomos de oxigênio
8) A massa de 3 moles de sulfeto de hidrogênio H2S é igual a: (com solução)
A. 33g B. 34g.
9) O volume ocupado por 2 moles de uma substância gasosa com a fórmula SO2 (n.s.): (com solução)
R. 22,4 litros. B. 33,6 litros. H. 44,8 litros. G. 67,2 litros.
10) a quantidade de dióxido de carbono CO2, que contém 36*10(23) moléculas, é igual a: (com solução)
11) Correspondência:
Tipo de ligação química:
1. Iônico B. Covalente polar C. Metálico
Fórmula química da substância:
A.CI2 B.K C.NaCI D.Fe D.NH3
12) Calcule o volume de oxigênio O2 com massa de 160 g (nº) (com solução)
13) Complete a definição: “A alotropia é um fenômeno...”
14) Selecione as propriedades que caracterizam o grafite.
R. Difícil
B. Macio, deixa marcas no papel.
B. Incolor, transparente.
D. Tem um leve brilho metálico
D. Eletricamente condutivo.
elétrons de nível 3?
1) Mg e Al 2) O e S 3) N e S 4) B e Al
2. Um átomo de um elemento formando uma substância simples - um não metal - corresponde a
circuito eletronico?
1) +11)2)8)1 2) +8)2)6 3) +12)2)8)2 4) +4)2)2
3. O nitrogênio apresenta o maior grau de oxidação quando combinado com a fórmula:
1) NO2 2) NÃO 3) NH3 4) N2O5
4. Qual substância possui uma ligação covalente apolar?
1) O2 2) H2O 3) CaCl2 4) Ba
5. A fórmula eletrônica 1s2 2s2 2p1 corresponde ao átomo:
1) berílio 2) silício 3) carbono 4) boro
6. Com o aumento da carga dos núcleos atômicos da série F -Cl - Br -I, não metálico
propriedades?
1) intensificar 2) enfraquecer 3) não mudar 4) mudar periodicamente
7. indique a fórmula de um composto com ligação química polar covalente:
1) H2 2) NH3 3) Ca3N2 4) C
8. O grau de oxidação do fósforo nos compostos P2O5, PH3, Ca3P2, respectivamente
igual?
1) +3, -3, +5 2) -3, +3, +5 3) +5, +5, -3 4) +5, -3, -3
9. As seguintes afirmações são verdadeiras?
A. No período, as propriedades metálicas dos átomos de elementos com ordem crescente
os números estão ficando mais fortes.
B. No período, as propriedades metálicas dos átomos de elementos com ordem crescente
os números estão enfraquecendo.
1) apenas A é verdadeiro 2) Ambos os julgamentos são verdadeiros 3) apenas B é verdadeiro 4) ambos os julgamentos não são
são verdadeiros
10. Um elemento químico em cujo átomo os elétrons estão distribuídos entre as camadas da seguinte forma:
2,8,8,2, na tabela periódica existe:
A) no 4º período, 2ª turma, subgrupo secundário
B) no 4º período, 2ª turma do subgrupo principal
B) no 3º período, 5ª turma do subgrupo principal
D) no 3º período, 5ª turma, subgrupo secundário
isologia da molécula de química orgânica
Agora é geralmente aceito que uma linha reta conectando dois átomos denota uma ligação de dois elétrons (ligação simples), cuja formação requer uma valência de cada um dos átomos ligados, duas linhas - uma ligação de quatro elétrons (ligação dupla), três linhas - uma ligação de seis elétrons (ligação tripla).
Uma representação de um composto com uma ordem conhecida de ligações entre todos os átomos usando ligações deste tipo é chamada de fórmula estrutural:
Para economizar tempo e espaço, são frequentemente utilizadas fórmulas abreviadas, nas quais algumas das conexões estão implícitas, mas não escritas:
Às vezes, especialmente nas séries carbocíclicas e heterocíclicas, as fórmulas são ainda mais simplificadas: não apenas algumas ligações não estão escritas, mas também alguns dos átomos de carbono e hidrogênio não são representados, mas estão apenas implícitos (nas interseções das linhas). ; fórmulas simplificadas:
Modelo tetraédrico do átomo de carbono
As ideias básicas sobre a estrutura química estabelecidas por A. M. Butlerov foram complementadas por Van't Hoff e Le Bel (1874), que desenvolveram a ideia do arranjo espacial dos átomos na molécula de uma substância orgânica e levantaram o questão da configuração espacial e conformação das moléculas. O trabalho de Van't Hoff, “Química no Espaço” (1874), marcou o início de uma direção frutífera na química orgânica - a estereoquímica, ou seja, o estudo da estrutura espacial.
Arroz. 1 - Modelos Van't Hoff: metano (a), etano (b), etileno (c) e acetileno (d)
Van't Hoff propôs um modelo tetraédrico do átomo de carbono. Segundo esta teoria, as quatro valências do átomo de carbono no metano são direcionadas para os quatro cantos do tetraedro, no centro do qual está um átomo de carbono, e nos vértices estão os átomos de hidrogênio (a). O etano, segundo Van't Hoff, pode ser imaginado como dois tetraedros conectados nos vértices e girando livremente em torno de um eixo comum (6). O modelo da molécula de etileno representa dois tetraedros conectados por arestas (c), e as moléculas com ligação tripla são representadas por um modelo em que os tetraedros estão em contato com planos (d).
Modelos deste tipo também provaram ser muito bem-sucedidos para moléculas complexas. Eles são usados com sucesso hoje para explicar uma série de questões estereoquímicas. A teoria proposta por Van't Hoff, embora adequada em quase todos os casos, não forneceu, contudo, uma explicação razoável do tipo e da essência das forças de ligação nas moléculas.
Um caminho inovador para o desenvolvimento de tecnologia para a criação de novos medicamentos
Primeiro, um modelo computacional do objeto é criado, e a modelagem computacional também é usada para formar moléculas no local de pesquisa. O modelo pode ser bidimensional ou tridimensional...
Espectros infravermelhos de moléculas
Em contraste com as faixas visível e ultravioleta, que são causadas principalmente pelas transições dos elétrons de um estado estacionário para outro...
Estudo da estrutura de compostos orgânicos utilizando métodos físicos
Todas as posições possíveis das moléculas no espaço tridimensional são reduzidas ao movimento translacional, rotacional e vibracional. Uma molécula composta por N átomos tem apenas 3N graus de liberdade de movimento...
Método de modelagem em química
Atualmente, é possível encontrar diversas definições dos conceitos “modelo” e “simulação”. Vejamos alguns deles. “Um modelo é entendido como uma representação de fatos, coisas e relações de um determinado campo do conhecimento na forma de uma representação mais simples...
Fundamentos científicos da reologia
O estado tensão-deformação de um corpo é geralmente tridimensional e não é realista descrever suas propriedades usando modelos simples. No entanto, naqueles raros casos em que os corpos uniaxiais são deformados...
Além da observação e do experimento, a modelagem desempenha um papel importante na compreensão do mundo natural e da química. Um dos principais objetivos da observação é procurar padrões nos resultados dos experimentos...
Dissolução de sólidos
Para a grande maioria dos processos, a função cinética é invariante em relação à concentração do reagente ativo e à temperatura. Em outras palavras, cada valor do tempo adimensional x corresponde a um valor muito específico...
Cálculo dos parâmetros químicos quânticos do PAS e determinação da relação estrutura-atividade usando o exemplo das sulfonamidas
Método refratométrico de análise em química
Síntese e análise de substâncias químicas na produção de gasolina
O modelo químico do processo de craqueamento catalítico é muito complexo. Vamos considerar a mais simples das reações que ocorrem durante o processo de craqueamento: CnH2n+2 > CmH2m+2 + CpH2p...
Síntese de sistema tecnológico químico (CTS)
Os processos de produção variam em suas características e grau de complexidade. Se o processo for complexo e decifrar seu mecanismo exigir muito esforço e tempo, utiliza-se uma abordagem empírica. Modelos matemáticos...
Comparação de reatores plug-flow e full-mix em modo de operação isotérmico
GBPOU NSO "Colégio Agrário Kolyvan"
Mapa tecnológico instrucional nº 1
de acordo com OUD. onze Química
profissões 35.01.23 Dona da propriedade, 19/01/04 Padeiro
Seção 1: Química Orgânica
Tópico 1.1: Conceitos básicos de química orgânica e teoria da estrutura dos compostos orgânicos.
Cargo : Fabricação de modelos de moléculas - representantes de diversas classes de compostos orgânicos.
Objetivo do trabalho:
generalizar e sistematizar o conhecimento dos alunos sobre a teoria da estrutura dos compostos orgânicos;
consolidar a capacidade de composição de fórmulas estruturais de hidrocarbonetos;
O aluno deverá alcançar os seguintes resultados:
pessoal:
− um sentimento de orgulho e respeito pela história e conquistas da ciência química nacional; comportamento quimicamente competente nas atividades profissionais e em casa no manuseio de produtos químicos, materiais e processos;
− disponibilidade para continuar a educação e formação avançada na atividade profissional escolhida e consciência objetiva do papel das competências químicas nesta;
− a capacidade de usar as conquistas da ciência química moderna e das tecnologias químicas para melhorar o próprio desenvolvimento intelectual na atividade profissional escolhida;
meta-sujeito:
− o uso de vários tipos de atividade cognitiva e operações intelectuais básicas (declaração do problema, formulação de hipóteses, análise e síntese, comparação, generalização, sistematização, identificação de relações de causa e efeito, busca de análogos, formulação de conclusões) para resolver o problema, utilizando métodos básicos de cognição (observação, experimento científico) para estudar diversos aspectos de objetos e processos químicos que precisam ser encontrados no campo profissional;
− a utilização de diversas fontes para obtenção de informações químicas, capacidade de avaliar sua confiabilidade para obter bons resultados na área profissional;
assunto :
− a formação de ideias sobre o lugar da química no quadro científico moderno do mundo;
Compreender o papel da química na formação dos horizontes de uma pessoa e da alfabetização funcional para resolver problemas práticos;
− domínio de conceitos, teorias, leis e padrões químicos fundamentais;
Uso confiável de terminologia e símbolos químicos;
− domínio dos métodos básicos de conhecimento científico utilizados em química: observação, descrição, medição, experimento;
Capacidade de processar, explicar os resultados de experiências e tirar conclusões;
− vontade e capacidade de aplicar métodos cognitivos na resolução de problemas práticos;
− desenvolveu capacidade de fornecer estimativas quantitativas e fazer cálculos usando fórmulas e equações químicas;
− conhecimento das regras de segurança no uso de produtos químicos;
− formação da própria posição em relação às informações químicas obtidas de diversas fontes.
Forma de estudo : Individual
Horário padrão: 2 horas
Equipamento de local de trabalho : Um conjunto de modelos de moléculas tipo bola e bastão, tabela “Hidrocarbonetos saturados”, tabela periódica, cartões de tecnologia instrucional, cadernos
Literatura:
Meios de educação: verbal (verbal), visual
Precauções de segurança: familiarizado com as regras de segurança no local de trabalho e no escritório.
Diretrizes
Hidrocarbonetos são substâncias orgânicas constituídas por átomos de carbono e hidrogênio. O átomo de carbono em todos os compostos orgânicos é tetravalente. Os átomos de carbono podem formar cadeias retas, ramificadas e fechadas. As propriedades das substâncias dependem não apenas da composição qualitativa e quantitativa, mas também da ordem de ligação dos átomos entre si. Substâncias que possuem a mesma fórmula molecular, mas estruturas diferentes são chamadas de isômeros. Prefixos indicam quantidadedi - dois,três - três,tetra - quatro;ciclo - significa fechado.
Os sufixos nos nomes dos hidrocarbonetos indicam a presença de uma ligação múltipla:
pt
ligação simples entre átomos de carbono(C-C);
pt
ligação dupla entre átomos de carbono(C=C);
em
ligação tripla entre átomos de carbono(COM
=
COM);
dieno
duas ligações duplas entre átomos de carbono(C = C - C = C);
Radicais:metil -CH 3 ; etil -C 2 N 5 ; cloro -Cl; bromo -Br.
Exemplo. Faça um modelo de uma molécula de propano.
Molécula de propanoC 3 H 8 contém três átomos de carbono e oito átomos de hidrogênio. Os átomos de carbono estão conectados entre si. Sufixo–pt indica a presença de uma ligação simples entre os átomos de carbono. Os átomos de carbono estão localizados em um ângulo de 109 28 minutos.
A molécula tem o formato de uma pirâmide. Desenhe átomos de carbono como círculos pretos, átomos de hidrogênio como círculos brancos e átomos de cloro como círculos verdes.
Ao desenhar modelos, observe a proporção dos tamanhos atômicos.
Encontre a massa molar usando a tabela periódica
EM 3 N 8 ) = 12 · 3 + 1 · 8 = 44 g/mol.
Para nomear um hidrocarboneto você precisa:
Escolha a corrente mais longa.
Número começando na aresta à qual a ligação radical ou múltipla está mais próxima.
Indique o radical se vários radicais forem indicados cada. (Número antes do nome).
Nomeie o radical, começando pelo menor radical.
Nomeie a cadeia mais longa.
Indique a posição da ligação múltipla. (Número após nome).
Exemplo

Ao compor fórmulas por nome, você precisa:
Determine o número de átomos de carbono na cadeia.
Determine a posição da ligação múltipla. (Número após nome).
Determine a posição dos radicais. (Número antes do nome).
Escreva as fórmulas dos radicais.
Por último, determine o número e a disposição dos átomos de hidrogênio.
Ordem de serviço
Tarefa nº 1 . Faça modelos de moléculas:
1) vários alcanos: metano, etano, butano, pentano, hexano, heptano, octano, nonano e decano;
2) Cicloalcanos: ciclopropano,ciclopetano
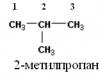
3) 2-metilpropano,
4) 1,2-dicloroetano.
Desenhe modelos moleculares em seu caderno. Escreva as fórmulas estruturais dessas substâncias. Encontre seus pesos moleculares.
Tarefa nº 2. Nomeie as substâncias:

Tarefa nº 3. Compor estrutural fórmulas de substâncias:
a) buteno-2, escreva seu isômero;
b) 3,3 - dimetilpentina-1.
Perguntas de controle
Dê a fórmula geral dos hidrocarbonetos saturados.
Quais substâncias são chamadas de homólogas e quais são isômeros?
Professor: Rachkovskaya A.I.
Química orgânica.
2.1.Tópico: " Teoria da estrutura dos compostos orgânicos"
2.1.1. Princípios básicos da teoria da estrutura dos compostos orgânicos e classificação dos compostos orgânicos.
1. Substâncias orgânicas naturais e sintéticas. Um pouco da história da química orgânica. Propriedades gerais das substâncias orgânicas (composição, tipo de ligação química, estrutura cristalina, solubilidade, relação com o aquecimento na presença de oxigênio e sem ele).
2. A teoria da estrutura dos compostos orgânicos por A.M. Desenvolvimento da teoria e seu significado.
3. Classificação das substâncias orgânicas.
As substâncias orgânicas receberam esse nome porque as primeiras substâncias estudadas desse grupo faziam parte de organismos vivos. A maioria das substâncias orgânicas atualmente conhecidas não são encontradas em organismos vivos; elas são obtidas (sintetizadas) em laboratório. Portanto, é feita uma distinção entre substâncias orgânicas naturais (naturais) (embora a maioria delas agora possa ser obtida em laboratório) e substâncias orgânicas que não existem na natureza - substâncias orgânicas sintéticas. Aqueles. O nome “substâncias orgânicas” é histórico e não tem muito significado. Todos os compostos orgânicos são compostos de carbono. As substâncias orgânicas incluem os compostos de carbono, exceto as substâncias simples formadas pelo carbono, seus óxidos, ácido carbônico e seus sais estudados no curso de química inorgânica. Em outras palavras: a química orgânica é a química dos compostos de carbono.
Breve história do desenvolvimento da química organizacional:
Berzelius, 1827, primeiro livro de química orgânica. Vitalistas. A doutrina da "força vital".
As primeiras sínteses orgânicas. Wöhler, 1824, síntese de ácido oxálico e uréia. Kolbe, 1845, ácido acético. Berthelot, 1845, gordo. Butlerov, 1861, substância açucarada.
Mas, como ciência, a química orgânica começou com a criação de uma teoria da estrutura dos compostos orgânicos. Uma contribuição significativa foi feita pelo cientista alemão F.A. Kekule e pelo escocês A.S. Mas a contribuição decisiva pertence, sem dúvida, ao químico russo A.M.
Dentre todos os elementos, o carbono se destaca pela capacidade de formar compostos estáveis nos quais seus átomos estão ligados entre si em longas cadeias de diversas configurações (linear, ramificada, fechada). A razão para esta habilidade: aproximadamente a mesma energia de ligação de C-C e C-O (para outros elementos a energia do segundo é muito maior). Além disso, um átomo de carbono pode estar em um dos três tipos de hibridização, formando ligações simples, duplas ou triplas, respectivamente, não apenas entre si, mas também com átomos de oxigênio ou nitrogênio. É verdade que com muito mais frequência (quase sempre) os átomos de carbono estão conectados aos átomos de hidrogênio. Se um composto orgânico contém apenas carbono e hidrogênio, os compostos são chamados de hidrocarbonetos. Todos os outros compostos podem ser considerados derivados de hidrocarbonetos nos quais alguns átomos de hidrogênio são substituídos por outros átomos ou grupos de átomos. Portanto, uma definição mais precisa: Os compostos orgânicos são hidrocarbonetos e seus derivados.
Existem muitos compostos orgânicos - mais de 10 milhões (cerca de 500 mil inorgânicos). A composição, estrutura e propriedades de todas as substâncias orgânicas têm muito em comum.
As substâncias orgânicas têm uma composição qualitativa limitada. Necessariamente C e H, frequentemente O ou N, menos frequentemente halogênios, fósforo, enxofre. Outros elementos são incluídos muito raramente. Mas o número de átomos numa molécula pode chegar a milhões e o peso molecular pode ser muito grande.
Estrutura dos compostos orgânicos. Porque composição - não metais. => Ligação química: covalente. Não polar e polar. Iônico muito raramente. => Estrutura cristalina na maioria das vezes molecular.
Propriedades físicas gerais: baixo ponto de ebulição e fusão. As substâncias orgânicas incluem gases, líquidos e sólidos fusíveis. Freqüentemente volátil e pode ter odor. Geralmente incolor. A maioria das substâncias orgânicas é insolúvel em água.
Propriedades químicas gerais:
1) quando aquecidas sem acesso de ar, todas as substâncias orgânicas ficam “carbonizadas”, ou seja, neste caso, forma-se carvão (mais precisamente, fuligem) e algumas outras substâncias inorgânicas. As ligações covalentes são quebradas, primeiro polares e depois apolares.
2) Quando aquecidas na presença de oxigênio, todas as substâncias orgânicas são facilmente oxidadas e os produtos finais da oxidação são dióxido de carbono e água.
Características do curso das reações orgânicas. As reações orgânicas envolvem moléculas durante a reação, algumas ligações covalentes devem ser quebradas e outras formadas. Portanto, as reações químicas envolvendo compostos orgânicos geralmente ocorrem muito lentamente, requerem o uso de temperatura e pressão elevadas, e as reações inorgânicas geralmente envolvem íons; As reações orgânicas raramente resultam em rendimentos elevados (geralmente inferiores a 50%). Muitas vezes são reversíveis; além disso, não uma, mas várias reações podem ocorrer, competindo entre si, o que significa que os produtos da reação serão uma mistura de diferentes compostos. Portanto, a forma de registro das reações orgânicas também é um pouco diferente. Aqueles. não utilizam equações químicas, mas sim esquemas de reações químicas nos quais não há coeficientes, mas as condições de reação são indicadas detalhadamente. Também é comum anotar os nomes da organização na equação. substâncias e tipo de reação.
Mas, em geral, as substâncias e reações orgânicas obedecem às leis gerais da química, e as substâncias orgânicas se transformam em substâncias inorgânicas ou podem ser formadas a partir de substâncias inorgânicas. O que mais uma vez enfatiza a unidade do mundo que nos rodeia.
Os princípios básicos da teoria da estrutura química, apresentados pelo jovem A.M. Butlerov no congresso internacional de cientistas naturais em 1861.
1). Os átomos nas moléculas estão conectados entre si em uma determinada ordem, de acordo com sua valência. A sequência de combinação de átomos é chamada estrutura química .
Valência é a capacidade dos átomos de formar um certo número de ligações (covalentes). A valência depende do número de elétrons desemparelhados em um átomo de um elemento porque as ligações covalentes são formadas pelo compartilhamento de pares de elétrons quando os elétrons estão emparelhados. O carbono em todas as substâncias orgânicas é tetravalente. Hidrogênio - 1, Oxigênio - P, nitrogênio - Ш, enxofre - P, cloro - 1.
Métodos para representar moléculas orgânicas.
Uma fórmula molecular é uma representação convencional da composição de uma substância. H 2 CO 3 - ácido carbônico, C 12 H 22 O 11 - sacarose. Essas fórmulas são convenientes para cálculos. Mas não fornecem informações sobre a estrutura e propriedades da substância. Portanto, mesmo as fórmulas moleculares em produtos orgânicos são escritas de uma maneira especial: CH 3 OH. Mas com muito mais frequência eles usam fórmulas estruturais. A fórmula estrutural reflete a ordem em que os átomos estão conectados em uma molécula (ou seja, estrutura química). E na base de qualquer molécula orgânica está esqueleto de carbono é uma cadeia de átomos de carbono interligados por ligações covalentes.
Fórmulas eletrônicas de moléculas - as ligações entre átomos são mostradas em pares de elétrons.
A fórmula estrutural completa mostra todas as conexões com traços. Uma ligação química formada por um par de elétrons é chamada de ligação simples e é representada por uma única linha na fórmula estrutural. Uma ligação dupla (=) é formada por dois pares de elétrons. Triplo (≡) é formado por três pares de elétrons. E o número total dessas ligações deve corresponder à valência do elemento.
 Em uma fórmula estrutural condensada, os travessões das ligações simples são omitidos e os átomos associados a um ou outro átomo de carbono são escritos imediatamente após ele (às vezes entre parênteses).
Em uma fórmula estrutural condensada, os travessões das ligações simples são omitidos e os átomos associados a um ou outro átomo de carbono são escritos imediatamente após ele (às vezes entre parênteses).
As fórmulas esqueléticas são ainda mais abreviadas. Mas eles são usados com menos frequência. Por exemplo:

As fórmulas estruturais refletem apenas a ordem de união dos átomos. Mas as moléculas de compostos orgânicos raramente têm uma estrutura plana. A imagem tridimensional de uma molécula é importante para a compreensão de muitas reações químicas. A imagem de uma molécula é descrita usando conceitos como comprimento e ângulo de ligação. Além disso, é possível a rotação livre em torno de ligações simples. Os modelos moleculares fornecem uma representação visual.
7.1. A figura mostra um experimento que ilustra que os corpos se expandem quando aquecidos. Com uma caneta, circule na imagem o objeto que foi aquecido neste experimento - uma bola ou um anel. Justifique sua resposta.
7.2. Escolha a afirmação correta.
De acordo com as ideias modernas, quando um frasco com água esfria, o nível da água no tubo cai porque... . 
7.3. As substâncias são constituídas por minúsculas partículas. Que fenômenos e experimentos confirmam isso?
7.4. A tabela mostra dados exatos sobre a variação do volume de água V em função do tempo t durante o aquecimento.
Responda às perguntas.
a) É possível afirmar que durante todo o tempo de observação a água do frasco foi aquecida uniformemente? Explique sua resposta.
b) Como o volume da água mudou quando aquecida?

8.1. Escolha a afirmação correta.
Se você aquecer uma unha, ela alongará e ficará mais espessa. Isso acontece porque quando aquecido... . 
8.2. Escreva as palavras molécula, gota, átomo em tal ordem que cada elemento subsequente faça parte do anterior.
8.3. A figura mostra modelos de moléculas de água, oxigênio e dióxido de carbono. Todas as moléculas contêm um átomo de oxigênio (preto). Preencha os espaços em branco do texto.

8.4. Meça o comprimento do seu braço, do cotovelo ao dedo mínimo, e compare a medida com o tamanho de uma molécula de água.
9.1. Preencha os espaços em branco do texto. “Em ____, o botânico inglês Robert Brown, olhando através de um microscópio...”

9.2. A figura mostra esquematicamente moléculas líquidas circundando um grão de tinta colocado nesse líquido. As setas indicam a direção do movimento das moléculas líquidas em um determinado momento.

9.3. Liste os fenômenos que são exemplos de movimento browniano.
9.4. A figura mostra uma linha tracejada ao longo da qual uma partícula de poeira se moveu no ar por vários segundos.

a) Explique por que o grão de poeira mudou muitas vezes a direção de seu movimento durante a observação.
Devido a colisões com moléculas de ar e outras partículas de poeira.
b) Na figura, indique os pontos em que a partícula de poeira foi afetada pelas moléculas que a rodeiam.
10.1. Água pura é despejada em um cilindro de vidro por cima e uma solução de sulfato de cobre é despejada no fundo através de um tubo estreito. O cilindro está em repouso quando Temperatura constante. Mostre na figura como ficará o conteúdo do cilindro em vários intervalos.

10.2. Duas bolas de borracha idênticas são conectadas por uma mangueira transparente (veja a figura), e a bola da esquerda em ambos os casos é preenchida com hidrogênio (colorir o hidrogênio de azul), a da direita está vazia na figura a e cheia de ar na figura b (colorir o ar de verde). A mangueira é presa entre as bolas.

10.3. Risque uma das palavras destacadas para completar a explicação correta do experimento descrito.

10.4. Experimento caseiro.
Coloque um pedaço de açúcar no fundo de um copo de água fria, mas não mexa. Anote quanto tempo você levou para detectar a presença de moléculas de açúcar na superfície da água do copo e qual “dispositivo” você usou.
11.1. Preencha as lacunas do texto com as palavras: mais forte; mais fraco; atração; repulsão.

11.2. Conecte os fenômenos e suas explicações correspondentes com linhas.

11.3. Risque uma das palavras destacadas para completar a explicação correta do experimento descrito.

11.4. Complete a frase para obter a explicação correta do fenômeno.
11.5. Preencha os espaços em branco do texto. “Na vida cotidiana, frequentemente encontramos o fenômeno de molhar e não molhar.”

12.1. Qual estado da matéria é caracterizado pelas características listadas?