pirmoji – vandens molekulė, antroji – anglies dioksido molekulė, trečioji – metano molekulė, ketvirtoji – sieros dioksido molekulė.
Sveiki, padėkite man išspręsti 2 chemijos testą8 klasė
tema „Paprastos medžiagos. Medžiagos kiekis“.
1 variantas.
A1. Elemento, sudarančio paprastą substanciją – nemetalą, ženklas:
1) Na 2) C 3) K 4) Al
A2. Paprasta medžiaga – metalas:
1) deguonis 2) varis 3) fosforas 4) siera
A3. Paprastos gyvsidabrio medžiagos fizinė būsena esant normaliai
sąlygos:
1) kietas 2) skystas 3) dujinis
A4. Cheminis ryšys yra kovalentinis nepolinis
iš esmės:
1) geležis 2) chloras 3) vanduo 4) varis
A5. Allotropinis deguonies modifikavimas:
1) grafitas 2) baltas fosforas 3) ozonas 4) anglis
A6. Žymėjimas 3O2 reiškia:
1) 2 deguonies molekulės
2) 3 deguonies molekulės
3) 5 deguonies atomai
4) 6 deguonies atomai
A7. 3 molių vandenilio sulfido H2S masė yra lygi:
1) 33 2) 34 3) 99 4) 102
A8. Tūris, kurį užima 2 moliai dujinės medžiagos su
formulė SO2 (n.s):
1)22,4 l. 2) 33,6 l. 3) 44,8 l. 4) 67,2 l.
A9. Medžiagų, turinčių joninį cheminį ryšį, grupė:
1) Cl2, H2, O2 2) KCl, NaBr, CaI2
3) H2O, CO2, NaCl 4) K2O, MgO, NaI
A10. Molinis tūris yra. . .
1) bet kokių dujų tūris Nr. 2) 2 g bet kokių dujų tūris esant nuliui
3) 1 molio dujų tūris Nr. 4) 12 * 1023 molekulių tūris.
A11. 3 chloro molekulės:
1)3Cl2 2)3Cl 3)Cl2 4)6Cl
1 klausimas. Nustatykite kietą, minkštą medžiagą, kuri palieka žymę popieriuje, turi lengvą metalinį blizgesį ir yra laidi elektrai:
1) deimantas 2) anglis 3) grafitas 4) baltas fosforas
AT 2. Molekulių skaičius 2 mmol vandens yra:
1) 12*1023. 2) 12*1020. 3) 18*1020 4) 12*1018
3 d. Medžiagos, išdėstytos didėjančia nemetalų tvarka
savybės:
1) K, Na, Rb, Li 2) Li, Na K, Rb 3) Rb, K, Na, Li 4) Na, Rb, K, Li
C1. Apskaičiuokite 140 kg tūrį. azoto N2 Nr.
A.Na B.C C.K D.Al
2) Paprasta medžiaga – metalas:
A. deguonis B. Varis C. Fosforas D. Siera
3) Paprastos medžiagos gyvsidabrio fizinė būsena įprastomis sąlygomis:
A. Kietas B. Skystis C. Dujinis
4) Cheminis ryšys yra kovalentinis nepolinis medžiagoje:
A. Geležis B. Skystis C. Dujinis
5) Allotropinis deguonies modifikavimas:
A. Grafitas B. Ozonas
B. Baltasis fosforas D. Deimantas
6) Elemento atomas, sudarantis paprastą medžiagą - metalą, atitinka elektroninę diagramą:
A. +18))) B. +3)) C. +6)) D. +15)))
288 21 24 285
7) Įrašas ZO2 reiškia:
A. 2 deguonies molekulės
B. 3 deguonies molekulės
B. 5 deguonies atomai
D. 3 deguonies atomai
8) 3 molių vandenilio sulfido H2S masė lygi: (su tirpalu)
A. 33 g B. 34 g C. 99 g. 102 g.
9) Tūris, kurį užima 2 moliai dujinės medžiagos, kurios formulė SO2 (n.s.): (su tirpalu)
A. 22,4 l. B. 33,6 l. H. 44,8 l. G. 67,2 l.
10) anglies dioksido CO2 kiekis, kuriame yra 36*10(23) molekulės, lygus: (su tirpalu)
11) Rungtynės:
Cheminio ryšio tipas:
1. Joninis B. Kovalentinis polinis C. Metalinis
Cheminė medžiagos formulė:
A.CI2 B.K C.NaCI D.Fe D.NH3
12) Apskaičiuokite deguonies O2 tūrį, kurio masė 160 g (nr.) (su tirpalu)
13) Užbaikite apibrėžimą: „Allotropija yra reiškinys...“
14) Pasirinkite grafitui būdingas savybes.
A. Sunkus
B. Minkštas, palieka žymes ant popieriaus.
B. Bespalvis, skaidrus.
D. Turi lengvą metalinį blizgesį
D. Elektrai laidus.
3 lygio elektronai?
1) Mg ir Al 2) O ir S 3) N ir S 4) B ir Al
2. Elemento atomas, sudarantis paprastą medžiagą – nemetalą – atitinka
elektronine grandine?
1) +11)2)8)1 2) +8)2)6 3) +12)2)8)2 4) +4)2)2
3. Azotas pasižymi didžiausiu oksidacijos laipsniu, kai jis derinamas su formule:
1) NO2 2)NO 3)NH3 4)N2O5
4. Kuri medžiaga turi kovalentinį nepolinį ryšį?
1) O2 2) H2O 3) CaCl2 4) Ba
5. Elektroninė formulė 1s2 2s2 2p1 atitinka atomą:
1) berilis 2) silicis 3) anglis 4) boras
6. Didėjant atomų branduolių krūviui serijoje F -Cl - Br -I, nemetalinis
savybės?
1) sustiprėti 2) susilpnėti 3) nesikeisti 4) periodiškai keistis
7. nurodykite junginio su kovalentiniu poliniu cheminiu ryšiu formulę:
1) H2 2) NH3 3) Ca3N2 4) C
8. Fosforo oksidacijos laipsnis junginiuose P2O5, PH3, Ca3P2 atitinkamai
lygus?
1) +3, -3, +5 2) -3, +3, +5 3) +5, +5, -3 4) +5, -3, -3
9. Ar teisingi šie teiginiai?
A. Laikotarpyje didėjančios tvarkos elementų atomų metalinės savybės
skaičiai stiprėja.
B. Laikotarpyje didėjančios tvarkos elementų atomų metalinės savybės
skaičiai silpsta.
1) tik A yra teisinga 2) Abu sprendimai yra teisingi 3) tik B yra teisingi 4) abu sprendimai nėra
yra tiesa
10. Cheminis elementas, kurio atome elektronai pasiskirstę tarp sluoksnių taip:
2,8,8,2, periodinėje lentelėje yra:
A) 4-ajame periode, 2-oje grupėje, antriniame pogrupyje
B) 4-ajame periode pagrindinio pogrupio 2-oji grupė
B) 3-iajame periode pagrindinio pogrupio 5-oji grupė
D) 3-iajame periode, 5-oje grupėje, antriniame pogrupyje
organinės chemijos molekulių izologija
Dabar visuotinai priimta, kad viena tiesi linija, jungianti du atomus, žymi vieną dviejų elektronų ryšį (viengubą jungtį), kuriai sukurti reikalingas vienas valentas iš kiekvieno surišto atomo, dvi linijos – vieną keturių elektronų ryšį (dvigubas ryšys), trys linijos – viena šešių elektronų jungtis (triguba jungtis).
Junginio, turinčio žinomą ryšių tarp visų atomų tvarką, naudojant šio tipo ryšius, vaizdavimas vadinamas struktūrine formule:
Siekiant sutaupyti laiko ir vietos, dažnai naudojamos sutrumpintos formulės, kuriose kai kurie ryšiai yra numanomi, bet neparašyti:
Kartais, ypač karbociklinėse ir heterociklinėse eilutėse, formulės dar labiau supaprastinamos: ne tik kai kurie ryšiai neparašomi, bet ir kai kurie anglies ir vandenilio atomai nepavaizduojami, o tik numanomi (linijų sankirtose). ; supaprastintos formulės:
Tetraedrinis anglies atomo modelis
A. M. Butlerovo išdėstytas pagrindines idėjas apie cheminę struktūrą papildė Vant Hoffas ir Le Belas (1874), išplėtę idėją apie erdvinį atomų išsidėstymą organinės medžiagos molekulėje ir iškėlę Molekulių erdvinės konfigūracijos ir konformacijos klausimas. Van't Hoffo darbas „Chemija erdvėje“ (1874) pažymėjo vaisingos organinės chemijos krypties – stereochemijos, t.y. erdvinės struktūros tyrimo, pradžią.
Ryžiai. 1 – Van't Hoff modeliai: metanas (a), etanas (b), etilenas (c) ir acetilenas (d)
Van't Hoffas pasiūlė tetraedrinį anglies atomo modelį. Remiantis šia teorija, keturios metano anglies atomo valencijos yra nukreiptos į keturis tetraedro kampus, kurių centre yra anglies atomas, o viršūnėse yra vandenilio atomai (a). Etanas, pasak Vant Hoffo, gali būti įsivaizduojamas kaip du tetraedrai, sujungti viršūnėse ir laisvai besisukantys apie bendrą ašį (6). Etileno molekulės modelis vaizduoja dvi tetraedras, sujungtas briaunomis (c), o molekulės su trigubu ryšiu pavaizduotos modeliu, kuriame tetraedrai liečiasi su plokštumomis (d).
Šio tipo modeliai taip pat pasirodė esąs labai sėkmingi sudėtingoms molekulėms. Šiandien jie sėkmingai naudojami daugeliui stereocheminių klausimų paaiškinti. Van't Hoffo pasiūlyta teorija, nors ir tinkama beveik visais atvejais, nepateikė pagrįsto rišamųjų jėgų molekulėse tipo ir esmės paaiškinimo.
Inovatyvus kelias į naujų vaistų kūrimo technologijų plėtrą
Pirmiausia sukuriamas kompiuterinis objekto modelis, o kompiuterinis modeliavimas taip pat naudojamas formuojant molekules tyrimo vietoje. Modelis gali būti dvimatis arba trimatis...
Infraraudonieji molekulių spektrai
Priešingai nei matomas ir ultravioletinis diapazonas, kurį daugiausia sukelia elektronų perėjimas iš vienos stacionarios būsenos į kitą...
Organinių junginių struktūros tyrimas fizikiniais metodais
Visos įmanomos molekulių padėties trimatėje erdvėje sumažinamos iki transliacinio, sukamojo ir vibracinio judėjimo. Molekulė, susidedanti iš N atomų, turi tik 3N judėjimo laisvės laipsnius...
Modeliavimo metodas chemijoje
Šiuo metu galite rasti daugybę skirtingų sąvokų „modelis“ ir „modeliavimas“ apibrėžimų. Pažvelkime į kai kuriuos iš jų. „Modelis suprantamas kaip tam tikros žinių srities faktų, dalykų ir santykių vaizdavimas paprastesnio...
Moksliniai reologijos pagrindai
Kūno įtempių ir deformacijų būsena paprastai yra trimatė ir nerealu jo savybes apibūdinti naudojant paprastus modelius. Tačiau tais retais atvejais, kai vienaašiai kūnai deformuojasi...
Be stebėjimo ir eksperimento, modeliavimas vaidina svarbų vaidmenį suprantant gamtos pasaulį ir chemiją. Vienas iš pagrindinių stebėjimo tikslų – eksperimentų rezultatuose ieškoti šablonų...
Kietųjų medžiagų tirpimas
Daugumos procesų kinetinė funkcija yra nekintanti aktyvaus reagento koncentracijos ir temperatūros atžvilgiu. Kitaip tariant, kiekviena bedimensio laiko x reikšmė atitinka labai konkrečią reikšmę...
PAS kvantinių cheminių parametrų apskaičiavimas ir struktūros ir aktyvumo ryšio nustatymas naudojant sulfonamidų pavyzdį
Refraktometrinis analizės metodas chemijoje
Cheminių medžiagų sintezė ir analizė benzino gamyboje
Cheminis katalizinio krekingo proceso modelis yra labai sudėtingas. Panagrinėkime paprasčiausias krekingo proceso metu vykstančias reakcijas: CnH2n+2 > CmH2m+2 + CpH2p...
Cheminės technologinės sistemos (CTS) sintezė
Gamybos procesai skiriasi savo ypatybėmis ir sudėtingumo laipsniu. Jei procesas sudėtingas ir jo mechanizmo iššifravimas reikalauja daug pastangų ir laiko, naudojamas empirinis metodas. Matematiniai modeliai...
Srauto ir pilno mišinio reaktorių palyginimas izoterminiu darbo režimu
GBPOU NSO "Kolyvan Agrar College"
Mokomasis technologinis žemėlapis Nr.1
pagal OUD. vienuolika Chemija
profesijos 35.01.23 Dvaro šeimininkė, 2004-01-19 Baker
1 skyrius. Organinė chemija
1.1 tema: Pagrindinės organinės chemijos sampratos ir organinių junginių sandaros teorija.
Darbo pavadinimas : Molekulių modelių kūrimas - įvairių organinių junginių klasių atstovai.
Darbo tikslas:
apibendrinti ir sisteminti studentų žinias apie organinių junginių sandaros teoriją;
įtvirtinti gebėjimą sudaryti angliavandenilių struktūrines formules;
Studentas turi pasiekti šiuos rezultatus:
Asmeninis:
− pasididžiavimo jausmas ir pagarba šalies chemijos mokslo istorijai ir pasiekimams; chemiškai kompetentingas elgesys profesinėje veikloje ir namuose tvarkant chemines medžiagas, medžiagas ir procesus;
− pasirengimas tęsti mokymąsi ir tobulinti pasirinktą profesinę veiklą bei objektyvus chemijos kompetencijų vaidmens suvokimas tame;
− gebėjimas panaudoti šiuolaikinio chemijos mokslo pasiekimus ir chemijos technologijas tobulinant savo intelektinį tobulėjimą pasirinktoje profesinėje veikloje;
meta tema:
− įvairių pažintinės veiklos rūšių ir pagrindinių intelektualinių operacijų (problemos išdėstymo, hipotezių formulavimo, analizės ir sintezės, palyginimo, apibendrinimo, sisteminimo, priežasties-pasekmės ryšių nustatymo, analogų paieškos, išvadų formulavimo) panaudojimas. spręsti problemą, naudojant pagrindinius pažinimo metodus (stebėjimą, mokslinį eksperimentą) tiriant įvairius cheminių objektų ir procesų aspektus, su kuriais reikia susidurti profesinėje srityje;
− įvairių šaltinių naudojimas cheminei informacijai gauti, gebėjimas įvertinti jos patikimumą, siekiant gerų rezultatų profesinėje srityje;
tema :
− idėjų apie chemijos vietą šiuolaikiniame moksliniame pasaulio paveiksle formavimas;
Suprasti chemijos vaidmenį formuojant žmogaus akiratį ir funkcinį raštingumą sprendžiant praktines problemas;
− pagrindinių cheminių sąvokų, teorijų, dėsnių ir modelių įsisavinimas;
Užtikrintas cheminės terminijos ir simbolių vartojimas;
− pagrindinių chemijoje naudojamų mokslo žinių metodų įsisavinimas: stebėjimas, aprašymas, matavimas, eksperimentas;
Gebėjimas apdoroti, paaiškinti eksperimentų rezultatus ir daryti išvadas;
− noras ir gebėjimas taikyti pažintinius metodus sprendžiant praktines problemas;
− išugdyti gebėjimai pateikti kiekybinius įverčius ir atlikti skaičiavimus naudojant chemines formules ir lygtis;
− saugos taisyklių išmanymas naudojant chemines medžiagas;
− formuoti savo poziciją cheminės informacijos, gautos iš įvairių šaltinių, atžvilgiu.
Studijų forma : individualus
Standartinis laikas: 2 valandos
Darbo vietos įranga : rutulinių molekulių modelių rinkinys, lentelė „Sotieji angliavandeniliai“, periodinė lentelė, mokomosios technologijų kortelės, sąsiuviniai
Literatūra:
Mokymosi priemonės: žodinis (žodinis), vaizdinis
Saugos priemonės: susipažinęs su saugos taisyklėmis darbo vietoje ir biure.
Gairės
Angliavandeniliai yra organinės medžiagos, susidedančios iš anglies ir vandenilio atomų. Anglies atomas visuose organiniuose junginiuose yra keturvalentinis. Anglies atomai gali sudaryti tiesias, šakotas ir uždaras grandines. Medžiagų savybės priklauso ne tik nuo kokybinės ir kiekybinės sudėties, bet ir nuo atomų tarpusavio ryšio tvarkos. Medžiagos, turinčios tą pačią molekulinę formulę, bet skirtingą struktūrą, vadinamos izomerai. Priešdėliai nurodo kiekįdi - du,trys - trys,tetra - keturi;ciklo - reiškia uždarą.
Priesagos angliavandenilių pavadinimuose rodo daugialypės jungties buvimą:
lt
vienguba jungtis tarp anglies atomų(C - C);
lt
dviguba jungtis tarp anglies atomų(C = C);
in
triguba jungtis tarp anglies atomų(SU
=
SU);
dieno
dvi dvigubos jungtys tarp anglies atomų(C = C - C = C);
Radikalai:metilo -CH 3 ; etilo -C 2 N 5 ; chloras -Cl; bromas -Br.
Pavyzdys. Padarykite propano molekulės modelį.
Propano molekulėC 3 H 8 yra trys anglies atomai ir aštuoni vandenilio atomai. Anglies atomai yra sujungti vienas su kitu. Priesaga– en rodo, kad tarp anglies atomų yra vienguba jungtis. Anglies atomai išsidėstę 109 kampu 28 minučių.
Molekulė turi piramidės formą. Nupieškite anglies atomus kaip juodus apskritimus, vandenilio atomus kaip baltus apskritimus, o chloro atomus kaip žalius apskritimus.
Piešdami modelius, stebėkite atomų dydžių santykį.
Raskite molinę masę naudodami periodinę lentelę
M (S 3 N 8 ) = 12 · 3 + 1 · 8 = 44 g/mol.
Norėdami pavadinti angliavandenilį, turite:
Pasirinkite ilgiausią grandinę.
Skaičius, prasidedantis nuo krašto, prie kurio radikalioji arba kartotinė jungtis yra arčiausiai.
Nurodykite radikalą, jei kiekvienas yra nurodytas po kelis radikalus. (Skaičius prieš vardą).
Pavadinkite radikalą, pradedant nuo mažiausio radikalo.
Pavadinkite ilgiausią grandinę.
Nurodykite daugialypės jungties padėtį. (Skaičius po pavadinimo).
Pavyzdys

Kurdami formules pagal pavadinimą, turite:
Nustatykite anglies atomų skaičių grandinėje.
Nustatykite daugialypės jungties padėtį. (Skaičius po pavadinimo).
Nustatykite radikalų padėtį. (Skaičius prieš vardą).
Užrašykite radikalų formules.
Galiausiai nustatykite vandenilio atomų skaičių ir išsidėstymą.
Darbo tvarka
Užduotis Nr.1 . Sukurkite molekulių modelius:
1) daugybė alkanų: metanas, etanas, butanas, pentanas, heksanas, heptanas, oktanas, nonanas ir dekanas;
2) cikloalkanai: ciklopropanas,ciklopetanas
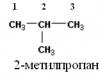
3) 2-metilpropanas,
4) 1,2-dichloretanas.
Pieškite molekulinius modelius savo užrašų knygelėje. Parašykite šių medžiagų struktūrines formules. Raskite jų molekulinį svorį.
2 užduotis. Pavadinkite medžiagas:

Užduotis Nr.3. Sukurti struktūrinės medžiagų formulės:
a) butenas-2, parašykite jo izomerą;
b) 3,3 - dimetilpentinas-1.
Kontroliniai klausimai
Pateikite bendrą sočiųjų angliavandenilių formulę.
Kurios medžiagos vadinamos homologais, o kurios – izomerai?
Mokytojas: Rachkovskaya A.I.
Organinė chemija.
2.1.Tema: " Organinių junginių sandaros teorija“
2.1.1. Pagrindiniai organinių junginių sandaros teorijos principai ir organinių junginių klasifikacija.
1. Natūralios ir sintetinės organinės medžiagos. Šiek tiek iš organinės chemijos istorijos. Bendrosios organinių medžiagų savybės (sudėtis, cheminio ryšio tipas, kristalų struktūra, tirpumas, santykis su kaitinimu esant deguoniui ir be jo).
2. Organinių junginių sandaros teorija A.M. Butlerovas. Teorijos raida ir jos reikšmė.
3. Organinių medžiagų klasifikacija.
Organinės medžiagos gavo savo pavadinimą, nes pirmosios iš tirtų šios grupės medžiagų buvo gyvų organizmų dalis. Daugumos šiuo metu žinomų organinių medžiagų gyvuose organizmuose nėra, jos gaunamos (sintetinamos) laboratorijoje. Todėl skiriamos natūralios (natūralios) organinės medžiagos (nors daugumą jų dabar galima gauti laboratorijoje), ir organinės medžiagos, kurių gamtoje nėra – sintetinės organinės medžiagos. Tie. Pavadinimas „organinės medžiagos“ yra istorinis ir neturi daug reikšmės. Visi organiniai junginiai yra anglies junginiai. Organinėms medžiagoms priskiriami anglies junginiai, išskyrus paprastas medžiagas, kurias sudaro anglis, jos oksidai, anglies rūgštis ir jos druskos, tiriamos neorganinės chemijos metu. Kitaip tariant: organinė chemija yra anglies junginių chemija.
Trumpa organizacinės chemijos raidos istorija:
Berzelius, 1827 m., pirmasis organinės chemijos vadovėlis. Vitalistai. „Gyvybės jėgos“ doktrina.
Pirmosios organinės sintezės. Wöhler, 1824, oksalo rūgšties ir karbamido sintezė. Kolbe, 1845, acto rūgštis. Bertelotas, 1845 m., storas. Butlerovas, 1861 m., saldi medžiaga.
Tačiau organinė chemija, kaip mokslas, prasidėjo sukūrus organinių junginių sandaros teoriją. Didelį indėlį į jį įnešė vokiečių mokslininkas F.A.Kekulė ir škotas A.S.Cooperis. Tačiau lemiamas indėlis neabejotinai priklauso rusų chemikui A. M. Butlerovui.
Tarp visų elementų anglis išsiskiria savo gebėjimu sudaryti stabilius junginius, kuriuose jos atomai yra susieti vienas su kitu ilgomis įvairios konfigūracijos grandinėmis (linijine, šakota, uždara). Šio gebėjimo priežastis: maždaug tokia pati C-C ir C-O ryšio energija (kitų elementų antrojo energija yra daug didesnė). Be to, anglies atomas gali būti viename iš trijų hibridizacijos tipų, sudarydamas atitinkamai pavienius, dvigubus arba trigubus ryšius ne tik tarpusavyje, bet ir su deguonies ar azoto atomais. Tiesa, daug dažniau (beveik visada) anglies atomai jungiasi su vandenilio atomais. Jei organiniame junginyje yra tik anglis ir vandenilis, junginiai vadinami angliavandeniliais. Visi kiti junginiai gali būti laikomi angliavandenilių dariniais, kuriuose kai kurie vandenilio atomai pakeisti kitais atomais arba atomų grupėmis. Todėl tikslesnis apibrėžimas: Organiniai junginiai yra angliavandeniliai ir jų dariniai.
Organinių junginių yra labai daug – daugiau nei 10 mln. (apie 500 tūkst. neorganinių). Visų organinių medžiagų sudėtis, struktūra ir savybės turi daug bendro.
Organinių medžiagų kokybinė sudėtis yra ribota. Būtinai C ir H, dažnai O arba N, rečiau halogenai, fosforas, siera. Kiti elementai įtraukiami labai retai. Tačiau atomų skaičius molekulėje gali siekti milijonus, o molekulinė masė gali būti labai didelė.
Organinių junginių sandara. Nes sudėtis – nemetalai. => Cheminis ryšys: kovalentinis. Nepolinis ir polinis. Joninis labai retai. => Kristalinė grotelė dažniausiai molekulinis.
Bendrosios fizinės savybės: žema virimo ir lydymosi temperatūra. Organinėms medžiagoms priskiriamos dujos, skysčiai ir tirpios kietosios medžiagos. Dažnai lakūs ir gali turėti kvapą. Paprastai bespalvis. Dauguma organinių medžiagų netirpsta vandenyje.
Bendrosios cheminės savybės:
1) kaitinant be oro prieigos visos organinės medžiagos „suanglėja“, t.y. tokiu atveju susidaro anglis (tiksliau, suodžiai) ir kai kurios kitos neorganinės medžiagos. Kovalentiniai ryšiai nutrūksta, pirmiausia poliniai, paskui nepoliniai.
2) Kaitinant esant deguoniui, visos organinės medžiagos lengvai oksiduojasi, o galutiniai oksidacijos produktai yra anglies dioksidas ir vanduo.
Organinių reakcijų eigos ypatumai. Organinėse reakcijose dalyvauja molekulės, vieni kovalentiniai ryšiai turi nutrūkti, o kiti susiformuoti. Todėl cheminės reakcijos, kuriose dalyvauja organiniai junginiai, paprastai vyksta labai lėtai. Dėl organinių reakcijų retai gaunamas didelis derlius (dažniausiai mažesnis nei 50%). Jie dažnai yra grįžtami, be to, gali įvykti ne viena, o kelios reakcijos, kurios konkuruoja tarpusavyje, o tai reiškia, kad reakcijos produktai bus skirtingų junginių mišinys. Todėl organinių reakcijų registravimo forma taip pat šiek tiek skiriasi. Tie. jose naudojamos ne cheminės lygtys, o cheminių reakcijų schemos, kuriose nėra koeficientų, tačiau detaliai nurodytos reakcijos sąlygos. Taip pat įprasta po lygtimi užrašyti org pavadinimus. medžiagos ir reakcijos tipas.
Bet apskritai organinės medžiagos ir reakcijos paklūsta bendriesiems chemijos dėsniams, o organinės medžiagos virsta neorganinėmis arba gali susidaryti iš neorganinių. Tai dar kartą pabrėžia mus supančio pasaulio vienybę.
Pagrindiniai cheminės struktūros teorijos principai, išdėstyti jauno A. M. Butlerovo tarptautiniame gamtos mokslininkų kongrese 1861 m.
1). Atomai molekulėse yra sujungti vienas su kitu tam tikra tvarka, atsižvelgiant į jų valentingumą. Atomų susijungimo seka vadinama chemine struktūra .
Valentas – tai atomų gebėjimas sudaryti tam tikrą skaičių ryšių (kovalentinių). Valentas priklauso nuo nesuporuotų elektronų skaičiaus elemento atome, nes kovalentiniai ryšiai susidaro dalijantis elektronų poras, kai elektronai yra suporuoti. Visose organinėse medžiagose esanti anglis yra keturvalentė. Vandenilis - 1, deguonis - P, azotas - Ш, siera - P, chloras - 1.
Organinių molekulių vaizdavimo metodai.
Molekulinė formulė yra įprastas medžiagos sudėties vaizdas. H 2 CO 3 - anglies rūgštis, C 12 H 22 O 11 - sacharozė. Tokios formulės yra patogios skaičiavimams. Tačiau jie nepateikia informacijos apie medžiagos struktūrą ir savybes. Todėl net molekulinės formulės organinėse medžiagose rašomos ypatingu būdu: CH 3 OH. Tačiau daug dažniau jie naudoja struktūrines formules. Struktūrinė formulė atspindi atomų susijungimo tvarką molekulėje (t.y. cheminę struktūrą). Ir bet kurios organinės molekulės pagrindas yra anglies skeletas yra anglies atomų grandinė, sujungta kovalentiniais ryšiais.
Elektroninės molekulių formulės – ryšiai tarp atomų rodomi elektronų poromis.
Visa struktūrinė formulė rodo visas jungtis su brūkšneliais. Cheminis ryšys, sudarytas iš vienos elektronų poros, vadinamas viengubu ryšiu ir struktūrinėje formulėje pavaizduotas viena linija. Dvigubą jungtį (=) sudaro dvi elektronų poros. Trigubą (≡) sudaro trys elektronų poros. Ir bendras šių ryšių skaičius turi atitikti elemento valentiškumą.
 Sutrumpintoje struktūrinėje formulėje pavienių ryšių brūkšniai praleidžiami, o iškart po jo (kartais skliausteliuose) rašomi su vienu ar kitu anglies atomu susiję atomai.
Sutrumpintoje struktūrinėje formulėje pavienių ryšių brūkšniai praleidžiami, o iškart po jo (kartais skliausteliuose) rašomi su vienu ar kitu anglies atomu susiję atomai.
Skeleto formulės dar labiau sutrumpintos. Tačiau jie naudojami rečiau. Pavyzdžiui:

Struktūrinės formulės atspindi tik atomų susijungimo tvarką. Tačiau organinių junginių molekulės retai turi plokščią struktūrą. Molekulės trimatis vaizdas yra svarbus norint suprasti daugelį cheminių reakcijų. Molekulės vaizdas apibūdinamas naudojant tokias sąvokas kaip ryšio ilgis ir ryšio kampas. Be to, galimas laisvas sukimasis aplink pavienius ryšius. Molekuliniai modeliai suteikia vizualinį vaizdą.
7.1. Paveikslėlyje parodytas eksperimentas, iliustruojantis, kad kūnai plečiasi kaitinant. Rašikliu apibraukite paveikslėlyje objektą, kuris buvo šildomas šio eksperimento metu – rutulį ar žiedą. Pagrįskite savo atsakymą.
7.2. Pasirinkite teisingą teiginį.
Remiantis šiuolaikinėmis idėjomis, kolbai su vandeniu atvėsus vandens lygis vamzdyje krenta, nes... . 
7.3. Medžiagos yra sudarytos iš mažų dalelių. Kokie reiškiniai ir eksperimentai tai patvirtina?
7.4. Lentelėje pateikti tikslūs duomenys apie vandens tūrio V pokytį kaip laiko t funkciją kaitinant.
Atsakyti į klausimus.
a) Ar galima teigti, kad per visą stebėjimo laiką vanduo kolboje buvo kaitinamas tolygiai? Paaiškinkite savo atsakymą.
b) Kaip pasikeitė vandens tūris kaitinant?

8.1. Pasirinkite teisingą teiginį.
Jei kaitinate nagą, jis pailgėja ir tampa storesnis. Taip atsitinka todėl, kad kaitinant... 
8.2. Parašykite žodžius molekulė, lašas, atomas tokia tvarka, kad kiekvienas paskesnis elementas būtų ankstesnio elemento dalis.
8.3. Paveiksle pavaizduoti vandens, deguonies ir anglies dioksido molekulių modeliai. Visose molekulėse yra deguonies atomas (juodas). Tekste užpildykite tuščias vietas.

8.4. Išmatuokite rankos ilgį nuo alkūnės iki mažojo piršto ir palyginkite matavimą su vandens molekulės dydžiu.
9.1. Tekste užpildykite tuščias vietas. „____ anglų botanikas Robertas Brownas, žiūrintis pro mikroskopą...“

9.2. Paveiksle schematiškai pavaizduotos skysčio molekulės, supančios į šį skystį įdėtą dažų grūdelį. Rodyklės rodo skysčio molekulių judėjimo kryptį tam tikru laiko momentu.

9.3. Išvardinkite tuos reiškinius, kurie yra Brauno judėjimo pavyzdžiai.
9.4. Paveikslėlyje pavaizduota nutrūkusi linija, kuria kelias sekundes ore judėjo dulkių dėmė.

a) Paaiškinkite, kodėl dulkės stebėjimo metu daug kartų keitė judėjimo kryptį.
Dėl susidūrimų su oro molekulėmis ir kitomis dulkių dalelėmis.
b) Paveiksle nurodykite taškus, kuriuose dulkių dalelę paveikė ją supančios molekulės.
10.1. Į stiklinį cilindrą iš viršaus pilamas grynas vanduo, o siauru vamzdeliu į dugną pilamas vario sulfato tirpalas. Cilindras yra ramybės būsenoje, kai pastovi temperatūra. Paveikslėlyje parodykite, kaip atrodys cilindro turinys įvairiais intervalais.

10.2. Du identiški guminiai rutuliukai yra sujungti permatoma žarna (žr. pav.), o kairysis rutulys abiem atvejais yra pripildytas vandenilio (nuspalvinkite vandenilį mėlynai), dešinysis a paveiksle yra tuščias, o b paveiksle pripildytas oro. (nuspalvinkite orą žaliai). Žarna užspaudžiama tarp rutuliukų.

10.3. Nubraukite vieną iš paryškintų žodžių, kad užbaigtumėte teisingą aprašyto eksperimento paaiškinimą.

10.4. Namų eksperimentas.
Į stiklinės šalto vandens dugną įdėkite gabalėlį cukraus, bet nemaišykite. Užrašykite, kiek laiko užtruko, kol stiklinėje vandens paviršiuje aptikote cukraus molekules ir kokį „prietaisą“ naudojote.
11.1. Teksto spragas užpildykite žodžiais: stipresnis; silpnesnis; patrauklumas; atstūmimas.

11.2. Reiškinius ir juos atitinkančius paaiškinimus sujunkite linijomis.

11.3. Nubraukite vieną iš paryškintų žodžių, kad užbaigtumėte teisingą aprašyto eksperimento paaiškinimą.

11.4. Užbaikite sakinį, kad gautumėte teisingą reiškinio paaiškinimą.
11.5. Tekste užpildykite tuščias vietas. „Kasdieniame gyvenime dažnai susiduriame su šlapinimu ir nesušlapimu.

12.1. Kokiai medžiagos būsenai būdingi išvardyti požymiai?