Legătură ionică
(au fost folosite materiale de pe site-ul http://www.hemi.nsu.ru/ucheb138.htm)
Legătura ionică are loc prin atracție electrostatică între ionii încărcați opus. Acești ioni se formează ca urmare a transferului de electroni de la un atom la altul. O legătură ionică se formează între atomii care au diferențe mari de electronegativitate (de obicei mai mari de 1,7 pe scara Pauling), de exemplu, între atomii de metal alcalin și de halogen.
Să luăm în considerare apariția unei legături ionice folosind exemplul formării NaCl.
Din formule electronice ale atomilor
Na 1s 2 2s 2 2p 6 3s 1 şi
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Se poate observa că pentru a finaliza nivelul exterior, este mai ușor pentru un atom de sodiu să cedeze un electron decât să câștige șapte, iar pentru un atom de clor este mai ușor să câștige un electron decât să câștige șapte. În reacțiile chimice, atomul de sodiu cedează un electron, iar atomul de clor îl ia. Ca urmare, învelișurile de electroni ale atomilor de sodiu și clor sunt transformate în învelișuri de electroni stabile ale gazelor nobile (configurația electronică a cationului de sodiu
Na + 1s 2 2s 2 2p 6,
iar configuraţia electronică a anionului clor este
Cl – - 1s 2 2s 2 2p 6 3s 2 3p 6).
Interacțiunea electrostatică a ionilor duce la formarea unei molecule de NaCl.
Natura legăturii chimice se reflectă adesea în starea de agregare și proprietățile fizice ale substanței. Compușii ionici precum clorura de sodiu NaCl sunt duri și refractari deoarece există forțe puternice de atracție electrostatică între sarcinile ionilor lor „+” și „–”.
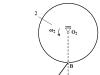
Ionul de clor încărcat negativ atrage nu numai ionul său de Na+, ci și alți ioni de sodiu din jurul său. Acest lucru duce la faptul că lângă oricare dintre ioni nu există un ion cu semnul opus, ci mai mulți.
Structura unui cristal de clorură de sodiu NaCl.
De fapt, există 6 ioni de sodiu în jurul fiecărui ion de clor și 6 ioni de clor în jurul fiecărui ion de sodiu. Această împachetare ordonată de ioni se numește cristal ionic. Dacă un singur atom de clor este izolat într-un cristal, atunci printre atomii de sodiu care îl înconjoară nu se mai poate găsi pe cel cu care a reacționat clorul.
Atrași unul de celălalt de forțele electrostatice, ionii sunt extrem de reticenți în a-și schimba locația sub influența forței externe sau a creșterii temperaturii. Dar dacă clorura de sodiu este topită și continuă să fie încălzită în vid, aceasta se evaporă, formând molecule biatomice de NaCl. Acest lucru sugerează că forțele de legătură covalente nu sunt niciodată complet oprite.
Caracteristicile de bază ale legăturilor ionice și proprietățile compușilor ionici
1. O legătură ionică este o legătură chimică puternică. Energia acestei legături este de ordinul 300 – 700 kJ/mol.
2. Spre deosebire de o legătură covalentă, o legătură ionică este nedirecțională deoarece un ion poate atrage ionii de semn opus față de sine în orice direcție.
3. Spre deosebire de o legătură covalentă, o legătură ionică este nesaturată, deoarece interacțiunea ionilor de semn opus nu duce la compensarea reciprocă completă a câmpurilor lor de forță.
4. În timpul formării moleculelor cu o legătură ionică, transferul complet de electroni nu are loc, prin urmare, legături ionice sută la sută nu există în natură. În molecula de NaCl, legătura chimică este doar 80% ionică.
5. Compușii cu legături ionice sunt solide cristaline care au puncte de topire și de fierbere ridicate.
6. Majoritatea compuşilor ionici sunt solubili în apă. Soluțiile și topiturile compușilor ionici conduc curentul electric.
Conexiune metalica
Cristalele metalice sunt structurate diferit. Dacă examinați o bucată de sodiu metalic, veți descoperi că aspectul ei este foarte diferit de sarea de masă. Sodiul este un metal moale, tăiat ușor cu un cuțit, aplatizat cu ciocanul, se poate topi cu ușurință într-o cană la o lampă cu alcool (punct de topire 97,8 o C). Într-un cristal de sodiu, fiecare atom este înconjurat de alți opt atomi similari.

Structura cristalină a Na metalic.
Figura arată că atomul de Na din centrul cubului are 8 vecini cei mai apropiați. Dar același lucru se poate spune despre orice alt atom dintr-un cristal, deoarece toți sunt la fel. Cristalul este format din fragmente care se repetă „la infinit” prezentate în această figură.
Atomii de metal la nivelul energetic exterior conțin un număr mic de electroni de valență. Deoarece energia de ionizare a atomilor de metal este scăzută, electronii de valență sunt slab reținuți în acești atomi. Ca rezultat, ionii încărcați pozitiv și electronii liberi apar în rețeaua cristalină a metalelor. În acest caz, cationii metalici sunt localizați în nodurile rețelei cristaline, iar electronii se mișcă liber în câmpul centrilor pozitivi, formând așa-numitul „gaz de electroni”.
Prezența unui electron încărcat negativ între doi cationi face ca fiecare cation să interacționeze cu acest electron.
Prin urmare, Legătura metalică este legătura dintre ionii pozitivi din cristalele metalice care are loc prin atracția electronilor care se mișcă liber în întregul cristal.
Deoarece electronii de valență dintr-un metal sunt distribuiți uniform în întregul cristal, o legătură metalică, ca o legătură ionică, este o legătură nedirecțională. Spre deosebire de o legătură covalentă, o legătură metalică este o legătură nesaturată. O legătură metalică diferă, de asemenea, de o legătură covalentă ca rezistență. Energia unei legături metalice este de aproximativ trei până la patru ori mai mică decât energia unei legături covalente.
Datorită mobilității mari a gazului de electroni, metalele se caracterizează printr-o conductivitate electrică și termică ridicată.
Cristalul metalic pare destul de simplu, dar de fapt structura sa electronică este mai complexă decât cea a cristalelor de sare ionică. Nu există suficienți electroni în învelișul exterior de electroni a elementelor metalice pentru a forma o legătură covalentă sau ionică „octetă” cu drepturi depline. Prin urmare, în stare gazoasă, majoritatea metalelor constau din molecule monoatomice (adică atomi individuali care nu sunt legați între ei). Un exemplu tipic este vaporii de mercur. Astfel, legătura metalică dintre atomii de metal are loc numai în stare lichidă și solidă de agregare.
O legătură metalică poate fi descrisă astfel: unii dintre atomii de metal din cristalul rezultat renunță la electronii de valență în spațiul dintre atomi (pentru sodiu acesta este... 3s1), transformându-se în ioni. Deoarece toți atomii de metal dintr-un cristal sunt aceiași, fiecare are șanse egale de a pierde un electron de valență.
Cu alte cuvinte, transferul de electroni între atomii de metal neutri și ionizați are loc fără consum de energie. În acest caz, unii electroni ajung întotdeauna în spațiul dintre atomi sub formă de „gaz de electroni”.
Acești electroni liberi, în primul rând, țin atomii de metal la o anumită distanță de echilibru unul de celălalt.
În al doilea rând, ele conferă metalelor o „strălucire metalică” caracteristică (electronii liberi pot interacționa cu quanta luminii).
În al treilea rând, electronii liberi oferă metalelor o conductivitate electrică bună. Conductivitatea termică ridicată a metalelor se explică și prin prezența electronilor liberi în spațiul interatomic - aceștia „răspund” cu ușurință la schimbările de energie și contribuie la transferul rapid al acestuia în cristal.

Un model simplificat al structurii electronice a unui cristal metalic.
******** Folosind metalul de sodiu ca exemplu, să luăm în considerare natura legăturii metalice din punctul de vedere al ideilor despre orbitalii atomici. Atomul de sodiu, ca multe alte metale, are o lipsă de electroni de valență, dar există orbiti de valență liberi. Singurul electron de 3s al sodiului este capabil să se deplaseze către oricare dintre orbitalii vecini liberi și aproape de energie. Pe măsură ce atomii dintr-un cristal se apropie, orbitalii exteriori ai atomilor vecini se suprapun, permițând electronilor cedați să se miște liber în tot cristalul.
Cu toate acestea, „gazul de electroni” nu este atât de dezordonat pe cât ar părea. Electronii liberi dintr-un cristal metalic se află în orbitali suprapusi și sunt într-o oarecare măsură împărțiți, formând ceva asemănător unor legături covalente. Sodiul, potasiul, rubidiul și alte elemente metalice S au pur și simplu puțini electroni în comun, astfel încât cristalele lor sunt fragile și fuzibile. Pe măsură ce numărul de electroni de valență crește, rezistența metalelor crește în general.
Astfel, legăturile metalice tind să fie formate de elemente ai căror atomi au puțini electroni de valență în învelișul lor exterior. Acești electroni de valență, care realizează legătura metalică, sunt împărțiți atât de mult încât se pot deplasa prin cristalul metalic și oferă o conductivitate electrică ridicată a metalului.
Un cristal de NaCl nu conduce electricitatea deoarece nu există electroni liberi în spațiul dintre ioni. Toți electronii donați de atomii de sodiu sunt ținuți ferm de ionii de clor. Aceasta este una dintre diferențele semnificative dintre cristalele ionice și cele metalice.
Ceea ce știți acum despre legăturile metalice ajută la explicarea maleabilității (ductilității) ridicate a majorității metalelor. Metalul poate fi aplatizat într-o foaie subțire și tras în sârmă. Faptul este că straturile individuale de atomi dintr-un cristal de metal pot aluneca unul pe altul relativ ușor: „gazul de electroni” mobil înmoaie constant mișcarea ionilor pozitivi individuali, ferindu-i unul de celălalt.
Desigur, nimic de genul acesta nu se poate face cu sarea de masă, deși sarea este și o substanță cristalină. În cristalele ionice, electronii de valență sunt legați strâns de nucleul atomului. Deplasarea unui strat de ioni față de altul apropie ionii cu aceeași sarcină și provoacă o repulsie puternică între ei, ducând la distrugerea cristalului (NaCl este o substanță fragilă).

Deplasarea straturilor unui cristal ionic determină apariția unor forțe repulsive mari între ionii similari și distrugerea cristalului.
Navigare
- Rezolvarea problemelor combinate pe baza caracteristicilor cantitative ale unei substanțe
- Rezolvarea problemelor. Legea constanței compoziției substanțelor. Calcule folosind conceptele de „masă molară” și „cantitate chimică” a unei substanțe
Scopul lecției
- Dați o idee despre legăturile chimice ale metalelor.
- Învățați să scrieți modelele de formare a legăturilor metalice.
- Familiarizați-vă cu proprietățile fizice ale metalelor.
- Învață să faci distincția clară între specii legături chimice .
Obiectivele lecției
- Aflați cum interacționează între ei atomi de metal
- Determinați modul în care o legătură metalică afectează proprietățile substanțelor formate de ea
Termeni cheie:
- Electronegativitatea - o proprietate chimică a unui atom, care este o caracteristică cantitativă a capacității unui atom dintr-o moleculă de a atrage perechi de electroni comune.
- Legătură chimică -fenomenul de interacțiune a atomilor, datorat suprapunerii norilor de electroni ai atomilor care interacționează.
- Conexiune metalica este o legătură a metalelor între atomi și ioni, formată prin împărțirea electronilor.
- Legătură covalentă - o legătură chimică formată prin suprapunerea unei perechi de electroni de valență. Electronii care asigură conexiunea se numesc o pereche de electroni comună. Există 2 tipuri: polare și nepolare.
- Legătură ionică - o legătură chimică care se formează între atomi nemetalici, în care o pereche de electroni comună merge la un atom cu electronegativitate mai mare. Ca rezultat, atomii se atrag ca și corpuri încărcate opus.
- Legătură de hidrogen
- o legătură chimică între un atom electronegativ și un atom de hidrogen H legat covalent de un alt atom electronegativ. Atomii electronegativi pot fi N, O sau F. Legăturile de hidrogen pot fi intermoleculare sau intramoleculare.
ÎN CURILE CURĂRILOR
Legături metalice chimice
Identificați elementele care se află în „coada” greșită. De ce?
Ca Fe P K Al Mg Na
Care elemente din tabel Mendeleev se numesc metale?
Astăzi vom afla ce proprietăți au metalele și cum depind ele de legătura care se formează între ionii metalici.
În primul rând, să ne amintim locația metalelor în tabelul periodic?
Metalele, după cum știm cu toții, de obicei nu există sub formă de atomi izolați, ci sub forma unei piese, lingouri sau produse metalice. Să aflăm ce adună atomii de metal într-un volum complet.
În exemplu vedem o bucată de aur. Și apropo, aurul este un metal unic. Folosind forjare, aurul pur poate fi folosit pentru a face folie de 0,002 mm grosime! Această foaie subțire de folie este aproape transparentă și are o nuanță verde la lumină. Ca urmare, dintr-un lingot de aur de mărimea unei cutii de chibrituri, puteți obține o folie subțire care va acoperi suprafața unui teren de tenis.
Din punct de vedere chimic, toate metalele se caracterizează prin ușurința renunțării la electroni de valență și, ca urmare, formarea de ioni încărcați pozitiv și prezintă doar oxidare pozitivă. De aceea metalele în stare liberă sunt agenți reducători. O caracteristică comună a atomilor de metal este dimensiunea lor mare în raport cu nemetale. Electronii exteriori sunt localizați la distanțe mari de nucleu și, prin urmare, sunt slab conectați la acesta, prin urmare sunt ușor separați.
Atomii unui număr mai mare de metale la nivel extern au un număr mic de electroni - 1,2,3. Acești electroni sunt îndepărtați cu ușurință, iar atomii de metal devin ioni.
Ме0 – n ē ⇆ Men+
atomi de metal – electroni ext. orbite ⇆ ioni metalici
În acest fel, electronii detașați se pot deplasa de la un ion la altul, adică devin liberi, parcă i-ar lega într-un singur întreg.De aceea, se dovedește că toți electronii detașați sunt comuni, deoarece este imposibil de înțeles. care electron îi aparține căruia dintre atomii de metal.
Electronii se pot combina cu cationi, apoi se formează temporar atomii, din care electronii sunt apoi rupți. Acest proces are loc constant și fără oprire. Se dovedește că în volumul metalului, atomii sunt transformați continuu în ioni și invers. În acest caz, un număr mic de electroni împărtășiți leagă un număr mare de atomi și ioni de metal. Dar este important ca numărul de electroni din metal să fie egal cu sarcina totală a ionilor pozitivi, adică se dovedește că, în general, metalul rămâne neutru din punct de vedere electric.
Acest proces este prezentat ca model - ionii metalici sunt într-un nor de electroni. Un astfel de nor de electroni se numește „gaz de electroni”.
De exemplu, în această imagine vedem cum electronii se mișcă printre ionii nemișcați în interiorul rețelei cristaline de metal. 
Orez. 2. Mișcarea electronilor
Pentru a înțelege mai bine ce este gazul electron și cum se comportă acesta în reacțiile chimice ale diferitelor metale, haideți să urmărim un videoclip interesant. (aurul este menționat doar ca culoare în acest videoclip!)
Acum putem scrie definiția: o legătură metalică este o legătură în metale între atomi și ioni, formată prin împărțirea electronilor.
Să comparăm toate tipurile de conexiuni pe care le cunoaștem și să le consolidăm pentru a le distinge mai bine, pentru asta vom urmări videoclipul.
Legătura metalică are loc nu numai în metale pure, ci este și caracteristică amestecurilor de diferite metale și aliaje în diferite stări de agregare.
Legătura metalică este importantă și determină proprietățile de bază ale metalelor
- conductivitate electrică – mișcarea aleatorie a electronilor în volumul metalului. Dar cu o mică diferență de potențial, astfel încât electronii să se miște în mod ordonat. Metalele cu cea mai bună conductivitate sunt Ag, Cu, Au, Al.
- plasticitate
Legăturile dintre straturile metalice nu sunt foarte semnificative, acest lucru permite straturilor să se deplaseze sub sarcină (deformează metalul fără a-l rupe). Cele mai bune metale deformabile (moale) sunt Au, Ag, Cu.
- stralucire metalica
Gazul de electroni reflectă aproape toate razele de lumină. Acesta este motivul pentru care metalele pure strălucesc atât de mult și au cel mai adesea o culoare gri sau albă. Metale care sunt cele mai bune reflectoare Ag, Cu, Al, Pd, Hg
Teme pentru acasă
Exercitiul 1
Alegeți formulele de substanțe care au
a) legătură polară covalentă: Cl2, KCl, NH3, O2, MgO, CCl4, SO2;
b) cu legătură ionică: HCl, KBr, P4, H2S, Na2O, CO2, CaS.
Exercițiul 2
Eliminați extra:
a) CuCl2, Al, MgS
b) N2, HCI, O2
c) Ca, CO2, Fe
d) MgCI2, NH3, H2
Metalul de sodiu, metalul de litiu și alte metale alcaline schimbă culoarea flăcării. Litiul metalic și sărurile sale dau focului o culoare roșie, sărurile metalice de sodiu și de sodiu îi dau o culoare galbenă, potasiul metalic și sărurile sale îi dau culoarea violet, iar rubidiul și cesiul îi dau o culoare violet, dar mai deschisă.
Orez. 4. O bucată de litiu metal 
Orez. 5. Colorarea la flacără cu metale
Litiu (Li). Litiul metal, ca și sodiul, este un metal alcalin. Ambele sunt solubile în apă. Sodiul, atunci când este dizolvat în apă, formează sodă caustică, un acid foarte puternic. Când metalele alcaline sunt dizolvate în apă, se eliberează multă căldură și gaz (hidrogen). Este recomandabil să nu atingeți astfel de metale cu mâinile, deoarece vă puteți arde.
Bibliografie
1. Lecție pe tema „Legătura chimică metalică”, profesor de chimie Tukhta Valentina Anatolyevna MOU „Școala secundară Yesenovichskaya”
2. F. A. Derkach „Chimie” - manual științific și metodologic. – Kiev, 2008.
3. L. B. Tsvetkova „Chimie anorganică” - ediția a II-a, corectată și extinsă. – Lvov, 2006.
4. V. V. Malinovsky, P. G. Nagorny „Chimie anorganică” - Kiev, 2009.
5. Glinka N.L. Chimie generală. – Ed. 27/Sub. ed. V.A. Rabinovici. – L.: Chimie, 2008. – 704 p.
Editat și trimis de Lisnyak A.V.
S-a lucrat la lecție:
Tukhta V.A.
Lisnyak A.V.
Puteți pune o întrebare despre educația modernă, puteți exprima o idee sau rezolva o problemă presantă la Forum educațional, unde un consiliu educațional de gândire și acțiune proaspătă se întrunește la nivel internațional. După ce a creat blog, Chimie clasa a VIII-a
Conexiune metalica
Ca rezultat al atracției electrostatice dintre cation și anion, se formează o moleculă.
Legătură ionică
Teoria legăturii ionice a fost propusă de 1916 ᴦ. om de știință german W. Kossel. Această teorie explică formarea conexiunilor între atomi de metale tipice și atomi tipic nemetale: CsF, CsCl, NaCl, KF, KCl, Na2O etc.
Conform acestei teorii, atunci când se formează o legătură ionică, atomii metalelor tipice renunță la electroni, iar atomii nemetalelor tipice acceptă electroni.
Ca urmare a acestor procese, atomii de metal sunt transformați în particule încărcate pozitiv, care sunt numite ioni pozitivi sau cationi; iar atomii nemetalici se transformă în ioni negativi - anioni. Sarcina cationului este egală cu numărul de electroni cedați.
Atomii de metal donează electroni stratului lor exterior și ionii rezultați au structuri electronice complete (strat electronic pre-exterior).
Mărimea sarcinii negative a anionului este egală cu numărul de electroni acceptați.
Atomii nemetalici acceptă numărul de electroni care este extrem de important pentru ei completarea unui octet electronic (stratul electronic exterior).
De exemplu: schema generală de formare a unei molecule de NaCl din atomi de Na și C1: Na°-le = Na +1 Formarea ionilor
Сl°+1е - = Сl -
Na +1 + Cl - = Na + Cl -
Na°+ Сl°= Na + Сl - Compus de ioni
· Legătura dintre ioni se numește în mod obișnuit legătură ionică.
Compușii care constau din ioni se numesc compuși ionici.
Suma algebrică a sarcinilor tuturor ionilor din molecula unui compus ionic trebuie să fie egală cu zero, deoarece orice moleculă este o particulă neutră din punct de vedere electric.
Nu există o graniță clară între legăturile ionice și covalente. O legătură ionică poate fi considerată un caz extrem al unei legături covalente polare, în care formarea unei perechi de electroni partajate. complet se deplasează spre atomul cu electronegativitate mai mare.
Majoritatea atomilor de metal tipici au un număr mic de electroni în stratul lor exterior de electroni (de obicei 1 până la 3); acești electroni se numesc electroni de valență. La atomii de metal, puterea legăturii dintre electronii de valență și nucleu este scăzută, adică atomii au energie de ionizare scăzută. Acest lucru face ușoară pierderea electronilor de valență h transformarea atomilor de metal în ioni încărcați pozitiv (cationi):
Ме° -ne ® Ме n +
În structura cristalină a unui metal, electronii de valență au capacitatea de a se muta cu ușurință de la un atom la altul, ceea ce duce la împărțirea electronilor de către toți atomii vecini. În mod simplificat, structura unui cristal metalic este reprezentată astfel: la nodurile rețelei cristaline se află ioni Me n+ și atomi Me°, iar electronii de valență se mișcă relativ liber între ei, stabilind conexiuni între toți atomii și ionii de metalul (Fig. 3). Acesta este un tip special de legătură chimică numită legătură metalică.
· Legătură metalică - o legătură între atomii și ionii metalelor dintr-o rețea cristalină, realizată de electroni de valență împărtășiți.
Datorită acestui tip de legături chimice, metalele au un anumit set de proprietăți fizice și chimice care le deosebesc de nemetale.
 Orez. 3. Diagrama rețelei cristaline a metalelor.
Orez. 3. Diagrama rețelei cristaline a metalelor.
Forța legăturii metalice asigură stabilitatea rețelei cristaline și plasticitatea metalelor (capacitatea de a suferi diferite procesări fără distrugere). Mișcarea liberă a electronilor de valență permite metalelor să conducă electricitatea și să se încălzească bine. Abilitatea de a reflecta undele luminoase (ᴛ.ᴇ. luciu metalic) se explică și prin structura rețelei cristaline a metalului.
Cu toate acestea, cele mai caracteristice proprietăți fizice ale metalelor bazate pe prezența unei legături metalice sunt:
■structură cristalină;
■strălucire și opacitate metalice;
■plasticitate, maleabilitate, fuzibilitate;
■conductivitate electrică și termică ridicată; și tendința de a forma aliaje.
Legături metalice - concept și tipuri. Clasificarea și caracteristicile categoriei „Conexiune metalică” 2017, 2018.
Însuși numele „legături metalice” indică faptul că vorbim despre structura internă a metalelor. Atomii majorității metalelor la nivelul energetic exterior conțin un număr mic de electroni de valență în comparație cu numărul total al celor exteriori care sunt aproape energetic... .
Legătura metalică se bazează pe împărțirea electronilor de valență aparținând nu la doi, ci la aproape toți atomii de metal din cristal. În metale, există mult mai puțini electroni de valență decât orbitalii liberi. Acest lucru creează condiții pentru libera circulație... .
Informații esențiale privind natura legăturilor chimice din metale pot fi obținute pe baza a două caracteristici în comparație cu compușii covalenți și ionici. Metalele, în primul rând, diferă de alte substanțe prin conductivitate electrică ridicată și... .
Informații semnificative despre natura legăturilor chimice din metale pot fi obținute pe baza a două trăsături caracteristice ale acestora în comparație cu compușii covalenti și ionici. Metalele, în primul rând, diferă de alte substanțe prin conductivitate electrică ridicată și... .
Hibridarea orbitalilor și configurația spațială a moleculelor Tipul de moleculă Orbitali inițiali ai atomului A Tipul de hibridizare Numărul de orbitali hibrizi ai atomului A Configurația spațială a moleculei AB2 AB3 AB4 s + p s + p + p s + p + p + p sp sp2 sp3 ... .
O legătură metalică este o legătură chimică cauzată de prezența electronilor relativ liberi. Caracteristic atât pentru metale pure, cât și pentru aliajele lor și compușii intermetalici. Mecanismul legăturii metalice La toate nodurile rețelei cristaline există... .
O moleculă este cea mai mică particulă a unei substanțe care are proprietățile sale chimice. Conform teoriei legăturii chimice, starea stabilă a unui element corespunde unei structuri cu formula electronică a nivelului exterior s2p6 (argon, cripton, radon și altele). In timpul educatiei....
Subiectele codificatorului examenului unificat de stat: Legătura chimică covalentă, varietățile și mecanismele de formare ale acesteia. Caracteristicile legăturilor covalente (polaritatea și energia de legătură). Legătură ionică. Conexiune metalica. Legătură de hidrogen
Legături chimice intramoleculare
În primul rând, să ne uităm la legăturile care apar între particulele din molecule. Se numesc astfel de conexiuni intramolecular.
Legătură chimică între atomii elementelor chimice are natură electrostatică și se formează datorită interacțiunea electronilor externi (de valență)., în mai mult sau mai puțin grad deținute de nuclee încărcate pozitiv atomi legați.
Conceptul cheie aici este ELECTRONEGATIVITATE. Acesta este cel care determină tipul de legătură chimică dintre atomi și proprietățile acestei legături.
este capacitatea unui atom de a atrage (reține) extern(valenţă) electroni. Electronegativitatea este determinată de gradul de atracție a electronilor exteriori către nucleu și depinde în primul rând de raza atomului și de sarcina nucleului.
Electronegativitatea este dificil de determinat fără ambiguitate. L. Pauling a întocmit un tabel de electronegativități relative (bazat pe energiile de legătură ale moleculelor diatomice). Cel mai electronegativ element este fluor cu sens 4 .
Este important să rețineți că în diferite surse puteți găsi diferite scale și tabele de valori ale electronegativității. Acest lucru nu ar trebui să fie alarmat, deoarece formarea unei legături chimice joacă un rol atomi și este aproximativ același în orice sistem.
Dacă unul dintre atomii din legătura chimică A:B atrage electronii mai puternic, atunci perechea de electroni se deplasează spre el. Cu atât mai mult diferenta de electronegativitate atomi, cu atât perechea de electroni se deplasează mai mult.
Dacă electronegativitățile atomilor care interacționează sunt egale sau aproximativ egale: EO(A)≈EO(B), atunci perechea de electroni comună nu se deplasează la niciunul dintre atomii: A: B. Această conexiune se numește covalent nepolar.
Dacă electronegativitățile atomilor care interacționează diferă, dar nu foarte mult (diferența de electronegativitate este aproximativ de la 0,4 la 2: 0,4<ΔЭО<2 ), apoi perechea de electroni este deplasată la unul dintre atomi. Această conexiune se numește polar covalent .
Dacă electronegativitățile atomilor care interacționează diferă semnificativ (diferența de electronegativitate este mai mare de 2: ΔEO>2), apoi unul dintre electroni este aproape complet transferat către alt atom, odată cu formarea ionii. Această conexiune se numește ionic.
Tipuri de bază de legături chimice − covalent, ionicȘi metal comunicatii. Să le aruncăm o privire mai atentă.
Legătură chimică covalentă
Legătură covalentă – este o legătură chimică , format din cauza formarea unei perechi de electroni comune A:B . Mai mult, doi atomi suprapune orbitali atomici. O legătură covalentă se formează prin interacțiunea atomilor cu o mică diferență de electronegativitate (de obicei între două nemetale) sau atomi ai unui element.
Proprietățile de bază ale legăturilor covalente
- se concentreze,
- saturabilitate,
- polaritate,
- polarizabilitate.
Aceste proprietăți de legătură influențează proprietățile chimice și fizice ale substanțelor.
Direcția de comunicare caracterizează structura chimică și forma substanțelor. Unghiurile dintre două legături se numesc unghiuri de legătură. De exemplu, într-o moleculă de apă unghiul de legătură H-O-H este 104,45 o, prin urmare molecula de apă este polară, iar într-o moleculă de metan unghiul de legătură H-C-H este 108 o 28′.

Saturabilitatea este capacitatea atomilor de a forma un număr limitat de legături chimice covalente. Numărul de legături pe care le poate forma un atom se numește.
Polaritate legarea are loc datorită distribuției neuniforme a densității electronice între doi atomi cu electronegativitate diferită. Legăturile covalente sunt împărțite în polare și nepolare.
Polarizabilitate conexiunile sunt capacitatea electronilor de legătură de a se deplasa sub influența unui câmp electric extern(în special, câmpul electric al altei particule). Polarizabilitatea depinde de mobilitatea electronilor. Cu cât electronul este mai departe de nucleu, cu atât este mai mobil și, în consecință, molecula este mai polarizabilă.

Legătură chimică covalentă nepolară
Există 2 tipuri de legături covalente - POLARȘi NON-POLARE .
Exemplu . Să luăm în considerare structura moleculei de hidrogen H2. Fiecare atom de hidrogen din nivelul său de energie exterior poartă 1 electron nepereche. Pentru a afișa un atom, folosim structura Lewis - aceasta este o diagramă a structurii nivelului de energie exterior al unui atom, când electronii sunt indicați prin puncte. Modelele de structură a punctelor Lewis sunt destul de utile atunci când lucrați cu elemente din a doua perioadă.
H. + . H = H:H
Astfel, o moleculă de hidrogen are o pereche de electroni comună și o legătură chimică H-H. Această pereche de electroni nu se deplasează la niciunul dintre atomii de hidrogen, deoarece Atomii de hidrogen au aceeași electronegativitate. Această conexiune se numește covalent nepolar .

Legătură covalentă nepolară (simetrică). este o legătură covalentă formată din atomi cu electronegativitate egală (de obicei aceleași nemetale) și, prin urmare, cu o distribuție uniformă a densității electronice între nucleele atomilor.
Momentul dipol al legăturilor nepolare este 0.
Exemple: H2 (H-H), O2 (O=O), S8.
Legătură chimică polară covalentă
Legătură polară covalentă este o legătură covalentă care apare între atomi cu electronegativitate diferită (de obicei, diverse nemetale) și este caracterizată deplasare perechea de electroni partajată la un atom mai electronegativ (polarizare).
Densitatea electronilor este mutată la atomul mai electronegativ - prin urmare, pe acesta apare o sarcină negativă parțială (δ-), iar pe atomul mai puțin electronegativ apare o sarcină pozitivă parțială (δ+, delta +).
Cu cât diferența de electronegativitate a atomilor este mai mare, cu atât este mai mare polaritate conexiuni și multe altele moment dipol . Forțe de atracție suplimentare acționează între moleculele vecine și sarcinile de semn opus, care crește putere comunicatii.
Polaritatea legăturilor afectează proprietățile fizice și chimice ale compușilor. Mecanismele de reacție și chiar reactivitatea legăturilor învecinate depind de polaritatea legăturii. Polaritatea conexiunii determină adesea polaritatea moleculeiși astfel afectează direct proprietăți fizice precum punctul de fierbere și punctul de topire, solubilitatea în solvenți polari.
Exemple: HCI, C02, NH3.
Mecanisme de formare a legăturilor covalente
Legăturile chimice covalente pot apărea prin două mecanisme:
1. Mecanism de schimb formarea unei legături chimice covalente are loc atunci când fiecare particulă furnizează un electron nepereche pentru a forma o pereche de electroni comună:
A . + . B= A:B
2. Formarea legăturii covalente este un mecanism în care una dintre particule oferă o pereche de electroni singuratică, iar cealaltă particulă oferă un orbital liber pentru această pereche de electroni:
A: + B= A:B

În acest caz, unul dintre atomi oferă o pereche singură de electroni ( donator), iar celălalt atom oferă un orbital vacant pentru acea pereche ( acceptor). Ca urmare a formării ambelor legături, energia electronilor scade, adică. acest lucru este benefic pentru atomi.
O legătură covalentă formată printr-un mecanism donor-acceptor nu este diferitîn proprietăţi din alte legături covalente formate prin mecanismul de schimb. Formarea unei legături covalente prin mecanismul donor-acceptor este tipică pentru atomii fie cu un număr mare de electroni la nivel de energie externă (donatori de electroni), fie, dimpotrivă, cu un număr foarte mic de electroni (acceptori de electroni). Capacitățile de valență ale atomilor sunt discutate mai detaliat în secțiunea corespunzătoare.
O legătură covalentă este formată printr-un mecanism donor-acceptor:
- într-o moleculă monoxid de carbon CO(legatura din molecula este tripla, prin mecanismul de schimb se formeaza 2 legaturi, una prin mecanismul donor-acceptor): C≡O;
- V ion de amoniu NH4+, în ioni amine organice de exemplu, în ionul de metilamoniu CH3-NH2+;
- V compuși complecși, o legătură chimică între atomul central și grupările ligand, de exemplu, în legătura Na de tetrahidroxoaluminat de sodiu între ionii de aluminiu și hidroxid;
- V acid azotic și sărurile sale- nitrați: HNO 3, NaNO 3, în alți compuși de azot;

- într-o moleculă ozon O3.
Caracteristicile de bază ale legăturilor covalente
Legăturile covalente se formează de obicei între atomi nemetalici. Principalele caracteristici ale unei legături covalente sunt lungime, energie, multiplicitate și direcționalitate.
Multiplicitatea legăturii chimice
Multiplicitatea legăturii chimice - Acest numărul de perechi de electroni partajați între doi atomi dintr-un compus. Multiplicitatea unei legături poate fi determinată destul de ușor din valorile atomilor care formează molecula.
De exemplu , în molecula de hidrogen H 2 multiplicitatea legăturilor este 1, deoarece Fiecare hidrogen are doar 1 electron nepereche în nivelul său de energie exterior, prin urmare se formează o pereche de electroni comună.
În molecula de oxigen O 2, multiplicitatea legăturilor este 2, deoarece Fiecare atom de la nivelul energetic exterior are 2 electroni nepereche: O=O.
În molecula de azot N2, multiplicitatea legăturilor este 3, deoarece între fiecare atom există 3 electroni nepereche la nivelul energetic exterior, iar atomii formează 3 perechi de electroni comuni N≡N.
Lungimea legăturii covalente
Lungimea legăturii chimice
este distanța dintre centrele nucleelor atomilor care formează legătura. Se determină prin metode fizice experimentale. Lungimea legăturii poate fi estimată aproximativ folosind regula aditivității, conform căreia lungimea legăturii în molecula AB este aproximativ egală cu jumătate din suma lungimilor legăturilor din moleculele A 2 și B 2: 
Lungimea unei legături chimice poate fi estimată aproximativ prin razele atomice formând o legătură, sau prin multiplicitatea comunicării, dacă razele atomilor nu sunt foarte diferite.
Pe măsură ce razele atomilor care formează o legătură cresc, lungimea legăturii va crește.
De exemplu
Pe măsură ce multiplicitatea legăturilor dintre atomi crește (ale căror raze atomice nu diferă sau diferă doar puțin), lungimea legăturii va scădea.
De exemplu . În seria: C–C, C=C, C≡C, lungimea legăturii scade.
Energia de comunicare
O măsură a puterii unei legături chimice este energia legăturii. Energia de comunicare determinată de energia necesară pentru a rupe o legătură și a îndepărta atomii care formează acea legătură la o distanță infinit de mare unul de celălalt.
O legătură covalentă este foarte rezistent. Energia sa variază de la câteva zeci la câteva sute de kJ/mol. Cu cât energia de legătură este mai mare, cu atât puterea de legătură este mai mare și invers.
Forța unei legături chimice depinde de lungimea legăturii, de polaritatea legăturii și de multiplicitatea legăturii. Cu cât o legătură chimică este mai lungă, cu atât se rupe mai ușor și cu cât energia legăturii este mai mică, cu atât rezistența acesteia este mai mică. Cu cât legătura chimică este mai scurtă, cu atât este mai puternică și energia de legătură este mai mare.
De exemplu, în seria de compuși HF, HCl, HBr de la stânga la dreapta, puterea legăturii chimice scade, deoarece Lungimea conexiunii crește.
Legătură chimică ionică

Legătură ionică este o legătură chimică bazată pe atracția electrostatică a ionilor.
Ioni se formează în procesul de acceptare sau donare de electroni de către atomi. De exemplu, atomii tuturor metalelor rețin slab electronii de la nivelul de energie exterior. Prin urmare, atomii de metal se caracterizează prin proprietăți de restaurare- capacitatea de a dona electroni.

Exemplu. Atomul de sodiu conține 1 electron la nivelul energetic 3. Renunțând cu ușurință la el, atomul de sodiu formează ionul Na + mult mai stabil, cu configurația electronică a gazului nobil neon Ne. Ionul de sodiu conține 11 protoni și doar 10 electroni, deci sarcina totală a ionului este -10+11 = +1:
+11N / A) 2 ) 8 ) 1 - 1e = +11 N / A +) 2 ) 8
Exemplu. Un atom de clor în nivelul său exterior de energie conține 7 electroni. Pentru a obține configurația unui atom de argon inert stabil Ar, clorul trebuie să câștige 1 electron. După adăugarea unui electron, se formează un ion de clor stabil, format din electroni. Sarcina totală a ionului este -1:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Notă:
- Proprietățile ionilor sunt diferite de proprietățile atomilor!
- Ioni stabili se pot forma nu numai atomi, dar de asemenea grupuri de atomi. De exemplu: ion de amoniu NH 4 +, ion sulfat SO 4 2- etc. Legăturile chimice formate de astfel de ioni sunt de asemenea considerate ionice;
- Legăturile ionice se formează de obicei între ele metaleȘi nemetale(grupe nemetalice);
Ionii rezultați sunt atrași datorită atracției electrice: Na + Cl -, Na 2 + SO 4 2-.
Să rezumam vizual diferența dintre tipurile de legături covalente și ionice:


Conexiune metalica este o legătură care se formează relativ electroni liberiîntre ionii metalici, formând o rețea cristalină.
Atomii de metal sunt de obicei localizați la nivelul energetic exterior unul până la trei electroni. Razele atomilor de metal, de regulă, sunt mari - prin urmare, atomii de metal, spre deosebire de nemetale, renunță destul de ușor la electronii lor exteriori, adică. sunt agenți reducători puternici.
Donând electroni, atomii de metal se transformă în ioni încărcați pozitiv . Electronii detașați sunt relativ liberi se miscaîntre ionii metalici încărcați pozitiv. Între aceste particule apare o conexiune, deoarece electronii în comun dețin cationi metalici aranjați în straturi împreună , creând astfel un destul de puternic rețea cristalină metalică . În acest caz, electronii se mișcă continuu haotic, adică. Apar în mod constant noi atomi neutri și noi cationi.

Interacțiuni intermoleculare
Separat, merită luate în considerare interacțiunile care apar între moleculele individuale dintr-o substanță - interacțiuni intermoleculare . Interacțiunile intermoleculare sunt un tip de interacțiune între atomi neutri în care nu apar noi legături covalente. Forțele de interacțiune dintre molecule au fost descoperite de Van der Waals în 1869 și au fost numite după el. Forțele Van dar Waals. Forțele Van der Waals sunt împărțite în orientare, inducţie Și dispersiv . Energia interacțiunilor intermoleculare este mult mai mică decât energia legăturilor chimice.
Forțele de orientare ale atracției apar între moleculele polare (interacțiunea dipol-dipol). Aceste forțe apar între moleculele polare. Interacțiuni inductive este interacțiunea dintre o moleculă polară și una nepolară. O moleculă nepolară este polarizată datorită acțiunii uneia polare, care generează atracție electrostatică suplimentară.
Un tip special de interacțiune intermoleculară sunt legăturile de hidrogen. - acestea sunt legături chimice intermoleculare (sau intramoleculare) care apar între molecule care au legături covalente foarte polare - H-F, H-O sau H-N. Dacă există astfel de legături într-o moleculă, atunci între molecule vor exista forțe de atracție suplimentare .
Mecanismul educației legăturile de hidrogen sunt parțial electrostatice și parțial donor-acceptor. În acest caz, donorul perechii de electroni este un atom al unui element puternic electronegativ (F, O, N), iar acceptorul sunt atomii de hidrogen conectați la acești atomi. Legăturile de hidrogen se caracterizează prin se concentreze în spaţiu şi saturare
Legăturile de hidrogen pot fi indicate prin puncte: H ··· O. Cu cât electronegativitatea atomului conectat la hidrogen este mai mare și cu cât dimensiunea acestuia este mai mică, cu atât legătura de hidrogen este mai puternică. Este tipic în primul rând pentru conexiuni fluor cu hidrogen , precum și să oxigen si hidrogen , Mai puțin azot cu hidrogen .

Legăturile de hidrogen apar între următoarele substanțe:
— fluorură de hidrogen HF(gaz, soluție de acid fluorhidric în apă - acid fluorhidric), apă H2O (abur, gheață, apă lichidă):
— soluție de amoniac și amine organice- intre amoniac si moleculele de apa;
— compuși organici în care se leagă O-H sau N-H: alcooli, acizi carboxilici, amine, aminoacizi, fenoli, anilina si derivatii ei, proteine, solutii de carbohidrati - monozaharide si dizaharide.
Legăturile de hidrogen afectează proprietățile fizice și chimice ale substanțelor. Astfel, atracția suplimentară între molecule face dificilă fierberea substanțelor. Substanțele cu legături de hidrogen prezintă o creștere anormală a punctului de fierbere.
De exemplu De regulă, odată cu creșterea greutății moleculare, se observă o creștere a punctului de fierbere al substanțelor. Cu toate acestea, într-o serie de substanțe H2O-H2S-H2Se-H2Te nu observăm o modificare liniară a punctelor de fierbere.

Și anume, la punctul de fierbere al apei este anormal de ridicat - nu mai puțin de -61 o C, după cum ne arată linia dreaptă, dar mult mai mult, +100 o C. Această anomalie se explică prin prezența legăturilor de hidrogen între moleculele de apă. Prin urmare, în condiții normale (0-20 o C) apa este lichid după starea de fază.
Conexiune metalica. Proprietățile legăturii metalice.
O legătură metalică este o legătură chimică cauzată de prezența electronilor relativ liberi. Caracteristic atât pentru metale pure, cât și pentru aliajele lor și compușii intermetalici.
Mecanism cu legături metalice
Ionii metalici pozitivi sunt localizați la toate nodurile rețelei cristaline. Între ei, electronii de valență se mișcă aleatoriu, precum moleculele de gaz, desprinse de atomi în timpul formării ionilor. Acești electroni acționează ca ciment, ținând împreună ionii pozitivi; în caz contrar, rețeaua s-ar dezintegra sub influența forțelor de respingere dintre ioni. În același timp, electronii sunt ținuți de ioni din rețeaua cristalină și nu pot părăsi aceasta. Forțele de cuplare nu sunt localizate sau dirijate. Din acest motiv, în majoritatea cazurilor apar numere mari de coordonare (de exemplu, 12 sau 8). Când doi atomi de metal se apropie, orbitalii din învelișul lor exterior se suprapun pentru a forma orbitali moleculari. Dacă un al treilea atom se apropie, orbitalul său se suprapune cu orbitalii primilor doi atomi, rezultând un alt orbital molecular. Când există mulți atomi, iau naștere un număr mare de orbitali moleculari tridimensionali, extinzându-se în toate direcțiile. Datorită mai multor orbitali care se suprapun, electronii de valență ai fiecărui atom sunt influențați de mulți atomi.
Rețele cristaline caracteristice
Cele mai multe metale formează una dintre următoarele rețele foarte simetrice, cu împachetare strânsă de atomi: cubic centrat pe corp, cubic centrat pe față și hexagonal.
Într-o rețea cubică centrată pe corp (bcc), atomii sunt localizați la vârfurile cubului și un atom este în centrul volumului cubului. Metalele au o rețea centrată pe corp cubic: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba etc.
Într-o rețea cubică centrată pe față (fcc), atomii sunt localizați la vârfurile cubului și în centrul fiecărei fețe. Metalele de acest tip au o rețea: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co etc.
Într-o rețea hexagonală, atomii sunt localizați la vârfurile și centrul bazelor hexagonale ale prismei, iar trei atomi sunt situați în planul mijlociu al prismei. Metalele au acest ambalaj de atomi: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca etc.
Alte proprietăți
Electronii care se mișcă liber provoacă o conductivitate electrică și termică ridicată. Substanțele care au o legătură metalică combină adesea rezistența cu plasticitatea, deoarece atunci când atomii sunt deplasați unul față de celălalt, legăturile nu se rup. O altă proprietate importantă este aromaticitatea metalică.
Metalele conduc bine căldura și electricitatea, sunt suficient de puternice și pot fi deformate fără distrugere. Unele metale sunt maleabile (pot fi forjate), altele sunt maleabile (puteți trage sârmă din ele). Aceste proprietăți unice sunt explicate printr-un tip special de legătură chimică care conectează atomii de metal între ei - o legătură metalică.
Metalele în stare solidă există sub formă de cristale de ioni pozitivi, ca și cum ar „pluti” într-o mare de electroni care se mișcă liber între ele.
Legăturile metalice explică proprietățile metalelor, în special rezistența lor. Sub influența unei forțe de deformare, o rețea metalică își poate schimba forma fără să se crape, spre deosebire de cristalele ionice.
Conductivitatea termică ridicată a metalelor se explică prin faptul că, dacă o bucată de metal este încălzită pe o parte, energia cinetică a electronilor va crește. Această creștere a energiei se va răspândi în „marea de electroni” în întreaga probă la viteză mare.
Conductivitatea electrică a metalelor devine, de asemenea, clară. Dacă se aplică o diferență de potențial la capetele unei probe de metal, norul de electroni delocalizați se va deplasa în direcția potențialului pozitiv: acest flux de electroni care se mișcă într-o direcție reprezintă curentul electric familiar.
Conexiune metalica. Proprietățile legăturii metalice. - concept și tipuri. Clasificarea și caracteristicile categoriei „Legătură metalică. Proprietăți ale legăturii metalice”. 2017, 2018.