prva je molekula vode, druga je molekula ugljičnog dioksida, treća je molekula metana, četvrta je molekula sumpor dioksida.
Pozdrav, molim vas pomozite mi riješiti test 2 iz kemije8. razred
na temu „Jednostavne tvari. Količina tvari."
Opcija 1.
A1. Oznaka elementa koji tvori jednostavnu tvar – nemetal:
1) Na 2) C 3) K 4) Al
A2. Jednostavna tvar – metal:
1) kisik 2) bakar 3) fosfor 4) sumpor
A3. Agregatno stanje jednostavne tvari žive u normali
Uvjeti:
1) kruto 2) tekuće 3) plinovito
A4. Kemijska veza je kovalentna nepolarna
u biti:
1) željezo 2) klor 3) voda 4) bakar
A5. Alotropska modifikacija kisika:
1) grafit 2) bijeli fosfor 3) ozon 4) ugljen
A6. Oznaka 3O2 znači:
1) 2 molekule kisika
2) 3 molekule kisika
3) 5 atoma kisika
4) 6 atoma kisika
A7. Masa 3 mola sumporovodika H2S jednaka je:
1) 33 2) 34 3) 99 4) 102
A8. Volumen koji zauzimaju 2 mola plinovite tvari sa
formula SO2 (n.s):
1)22,4 l. 2) 33,6 l. 3) 44,8 l. 4) 67,2 l.
A9. Skupina tvari s ionskim tipom kemijske veze:
1) Cl2, H2, O2 2) KCl, NaBr, CaI2
3) H2O, CO2, NaCl 4) K2O, MgO, NaI
A10. Molarni volumen je. . .
1) volumen bilo kojeg plina na br. 2) volumen 2 g bilo kojeg plina na nuli
3) volumen 1 mola bilo kojeg plina na br.
A11. 3 molekule klora:
1)3Cl2 2)3Cl 3)Cl2 4)6Cl
P1. Prepoznajte tvrdu, meku tvar koja ostavlja trag na papiru, ima blagi metalni sjaj i električki je vodljiva:
1) dijamant 2) ugljen 3) grafit 4) bijeli fosfor
U 2. Broj molekula u 2 mmol vode je:
1) 12*1023. 2) 12*1020. 3) 18*1020 4) 12*1018
U 3. Tvari poredane u rastućem redoslijedu nemetala
Svojstva:
1) K, Na, Rb, Li 2) Li, Na K, Rb 3) Rb, K, Na, Li 4) Na, Rb, K, Li
C1. Izračunaj obujam mase 140 kg. dušik N2 na br.
A.Na B.C C.K D.Al
2) Jednostavna tvar - metal:
A. kisik B. bakar C. fosfor D. sumpor
3) Agregatno stanje jednostavne tvari žive u normalnim uvjetima:
A. Čvrsto B. Tekuće C. Plinovito
4) Kemijska veza je kovalentna nepolarna u tvari:
A. Željezo B. Tekuće C. Plinovito
5) Alotropska modifikacija kisika:
A. Grafit B. Ozon
B. Bijeli fosfor D. Dijamant
6) Atom elementa koji tvori jednostavnu tvar - metal, odgovara elektroničkom dijagramu:
A. +18))) B. +3)) C. +6)) D. +15)))
288 21 24 285
7) Unos ZO2 znači:
A. 2 molekule kisika
B. 3 molekule kisika
B. 5 atoma kisika
D. 3 atoma kisika
8) Masa 3 mola sumporovodika H2S jednaka je: (s otopinom)
A. 33 g. C. 99 g.
9) Zapremina koju zauzimaju 2 mola plinovite tvari formule SO2 (n.s.): (s otopinom)
A. 22,4 l. B. 33,6 l. H. 44,8 l. G. 67,2 l.
10) količina ugljičnog dioksida CO2, koja sadrži 36*10(23) molekula, jednaka je: (s otopinom)
11) Podudaranje:
Vrsta kemijske veze:
1. Ionski B. Kovalentni polarni C. Metalni
Kemijska formula tvari:
A.CI2 B.K C.NaCI D.Fe D.NH3
12) Izračunajte volumen kisika O2 mase 160 g (br.) (s otopinom)
13) Dopuni definiciju: “Alotropija je fenomen...”
14) Odaberite svojstva koja karakteriziraju grafit.
A. Teško
B. Mekano, ostavlja tragove na papiru.
B. Bezbojan, proziran.
D. Ima blagi metalni sjaj
D. Električno vodljiv.
elektroni razine 3?
1) Mg i Al 2) O i S 3) N i S 4) B i Al
2. Atom elementa koji tvori jednostavnu tvar - nemetal - odgovara
elektronički sklop?
1) +11)2)8)1 2) +8)2)6 3) +12)2)8)2 4) +4)2)2
3. Dušik pokazuje najveći stupanj oksidacije u kombinaciji s formulom:
1) NO2 2)NO 3)NH3 4)N2O5
4. Koja tvar ima kovalentnu nepolarnu vezu?
1) O2 2) H2O 3) CaCl2 4) Ba
5. Elektronska formula 1s2 2s2 2p1 odgovara atomu:
1) berilij 2) silicij 3) ugljik 4) bor
6. S povećanjem naboja atomskih jezgri u seriji F -Cl - Br -I, nemetalni
Svojstva?
1) pojačati 2) oslabiti 3) ne mijenjati se 4) povremeno se mijenjati
7. navedite formulu spoja s kovalentnom polarnom kemijskom vezom:
1) H2 2) NH3 3) Ca3N2 4) C
8. Stupanj oksidacije fosfora u spojevima P2O5, PH3, Ca3P2, respektivno
jednak?
1) +3, -3, +5 2) -3, +3, +5 3) +5, +5, -3 4) +5, -3, -3
9. Jesu li sljedeće tvrdnje točne?
A. U razdoblju, metalna svojstva atoma elemenata s povećanjem reda
brojke su sve jače.
B. U razdoblju, metalna svojstva atoma elemenata s porastom reda
brojevi slabe.
1) samo je A istinito 2) oba suda su istinita 3) samo je B istinito 4) oba suda nisu
su istiniti
10. Kemijski element u čijem su atomu elektroni raspoređeni među slojevima na sljedeći način:
2,8,8,2, u periodnom sustavu postoji:
A) u 4. razdoblju, 2. skupina, sekundarna podskupina
B) u 4. razdoblju 2. skupina glavne podskupine
B) u 3. razdoblju 5. skupina glavne podskupine
D) u 3. razdoblju, 5. skupina, sekundarna podskupina
organska kemija izologija molekula
Sada je općeprihvaćeno da jedna ravna linija koja povezuje dva atoma označava jednu dvoelektronsku vezu (jednostruku vezu), za čije stvaranje je potrebna jedna valencija svakog od vezanih atoma, dvije linije - jednu četveroelektronsku vezu (dvostruka veza), tri linije - jedna šesteroelektronska veza (trostruka veza).
Prikaz spoja s poznatim redoslijedom veza između svih atoma pomoću veza ove vrste naziva se strukturna formula:
Radi uštede vremena i prostora često se koriste skraćene formule u kojima se neke veze podrazumijevaju, ali nisu napisane:
Ponekad, posebno u karbocikličkim i heterocikličkim serijama, formule su još više pojednostavljene: ne samo da neke veze nisu napisane, nego također neki atomi ugljika i vodika nisu prikazani, već su samo implicirani (na sjecištima linija) ; pojednostavljene formule:
Tetraedarski model atoma ugljika
Osnovne ideje o kemijskoj strukturi koje je postavio A. M. Butlerov dopunili su Van't Hoff i Le Bel (1874.), koji su razvili ideju o prostornom rasporedu atoma u molekuli organske tvari i podigli pitanje prostorne konfiguracije i konformacije molekula. Van't Hoffovo djelo “Kemija u svemiru” (1874.) označilo je početak plodnog pravca u organskoj kemiji - stereokemije, odnosno proučavanja prostorne strukture.
Riža. 1 - Van't Hoff modeli: metan (a), etan (b), etilen (c) i acetilen (d)
Van't Hoff je predložio tetraedarski model ugljikovog atoma. Prema toj teoriji, četiri valencije atoma ugljika u metanu usmjerene su prema četiri kuta tetraedra u čijem se središtu nalazi atom ugljika, a na vrhovima su atomi vodika (a). Etan se, prema Van't Hoffu, može zamisliti kao dva tetraedra spojena vrhovima koji slobodno rotiraju oko zajedničke osi (6). Model molekule etilena predstavlja dva tetraedra povezana bridovima (c), a molekule s trostrukom vezom predstavljene su modelom u kojem su tetraedri u dodiru s ravninama (d).
Modeli ovog tipa također su se pokazali vrlo uspješnima za složene molekule. Danas se uspješno koriste za objašnjenje niza stereokemijskih pitanja. Teorija koju je predložio Van't Hoff, iako prikladna u gotovo svim slučajevima, međutim, nije pružila razumno objašnjenje vrste i suštine veznih sila u molekulama.
Inovativni put u razvoj tehnologije za stvaranje novih lijekova
Prvo se izrađuje računalni model objekta, a pomoću računalnog modeliranja formiraju se molekule na mjestu istraživanja. Model može biti dvodimenzionalan ili trodimenzionalan...
Infracrveni spektri molekula
Za razliku od vidljivog i ultraljubičastog područja, koji su uglavnom uzrokovani prijelazima elektrona iz jednog stacionarnog stanja u drugo...
Proučavanje strukture organskih spojeva fizikalnim metodama
Svi mogući položaji molekula u trodimenzionalnom prostoru svode se na translatorno, rotacijsko i vibracijsko gibanje. Molekula koja se sastoji od N atoma ima samo 3N stupnjeva slobode kretanja...
Metoda modeliranja u kemiji
Trenutno možete pronaći mnogo različitih definicija pojmova "model" i "simulacija". Pogledajmo neke od njih. „Model se shvaća kao prikaz činjenica, stvari i odnosa određenog područja znanja u obliku jednostavnijeg...
Znanstvene osnove reologije
Naponsko-deformirano stanje tijela općenito je trodimenzionalno i nerealno je opisivati njegova svojstva jednostavnim modelima. Međutim, u onim rijetkim slučajevima kada se jednoosna tijela deformiraju...
Uz promatranje i eksperimentiranje, modeliranje igra važnu ulogu u razumijevanju prirodnog svijeta i kemije. Jedan od glavnih ciljeva promatranja je traženje obrazaca u rezultatima pokusa...
Otapanje čvrstih tvari
Za veliku većinu procesa, kinetička funkcija je nepromjenjiva u odnosu na koncentraciju aktivnog reagensa i temperaturu. Drugim riječima, svaka vrijednost bezdimenzionalnog vremena x odgovara vrlo specifičnoj vrijednosti...
Izračun kvantno kemijskih parametara PAS i određivanje odnosa struktura-aktivnost na primjeru sulfonamida
Refraktometrijska metoda analize u kemiji
Sinteza i analiza kemijskih tvari u proizvodnji benzina
Kemijski model procesa katalitičkog krekiranja vrlo je složen. Razmotrimo najjednostavniju reakciju koja se odvija tijekom procesa krekiranja: CnH2n+2 > CmH2m+2 + CpH2p...
Sinteza kemijsko-tehnološkog sustava (CTS)
Proizvodni procesi razlikuju se po svojim značajkama i stupnju složenosti. Ako je proces složen i dešifriranje njegovog mehanizma zahtijeva puno truda i vremena, koristi se empirijski pristup. Matematički modeli...
Usporedba reaktora plug-flow i full-mix reaktora u izotermnom načinu rada
GBPOU NSO "Kolyvan Agrarian College"
Instruktivno tehnološka karta br.1
prema OUD. jedanaest Kemija
profesije 35.01.23 Gospodarica imanja, Baker, 19.01.04
Sekcija 1: Organska kemija
Tema 1.1: Osnovni pojmovi organske kemije i teorije strukture organskih spojeva.
Naziv radnog mjesta : Izrada modela molekula - predstavnika različitih klasa organskih spojeva.
Cilj rada:
uopćiti i usustaviti znanja studenata o teoriji strukture organskih spojeva;
učvrstiti sposobnost sastavljanja strukturnih formula ugljikovodika;
Student mora postići sljedeće rezultate:
osobno:
− osjećaj ponosa i poštovanja prema povijesti i dostignućima domaće kemijske znanosti; kemijski kompetentno ponašanje u profesionalnim aktivnostima i kod kuće pri rukovanju kemikalijama, materijalima i procesima;
− spremnost na nastavak obrazovanja i usavršavanja u odabranoj stručnoj djelatnosti i objektivna svijest o ulozi kemijskih kompetencija u tome;
− sposobnost korištenja dostignuća suvremene kemijske znanosti i kemijske tehnologije za unapređenje vlastitog intelektualnog razvoja u odabranoj profesionalnoj djelatnosti;
meta-predmet:
− korištenje različitih vrsta kognitivnih aktivnosti i osnovnih intelektualnih operacija (postavka problema, formuliranje hipoteza, analiza i sinteza, usporedba, generalizacija, sistematizacija, utvrđivanje uzročno-posljedičnih veza, traženje analoga, formuliranje zaključaka) za rješavanje problema, korištenje osnovnih metoda spoznaje (promatranje, znanstveni eksperiment) za proučavanje različitih aspekata kemijskih objekata i procesa s kojima se treba susresti u stručnom području;
− korištenje različitih izvora za dobivanje kemijskih informacija, sposobnost procjene njihove pouzdanosti u svrhu postizanja dobrih rezultata u stručnom području;
subjekt :
− formiranje ideja o mjestu kemije u suvremenoj znanstvenoj slici svijeta;
Razumijevanje uloge kemije u oblikovanju čovjekovih horizonta i funkcionalne pismenosti za rješavanje praktičnih problema;
− ovladavanje temeljnim kemijskim pojmovima, teorijama, zakonima i uzorcima;
Samouvjereno korištenje kemijske terminologije i simbola;
− ovladavanje osnovnim metodama znanstvenih spoznaja koje se koriste u kemiji: promatranje, opisivanje, mjerenje, eksperiment;
Sposobnost obrade, obrazloženja rezultata pokusa i zaključivanja;
− spremnost i sposobnost primjene kognitivnih metoda u rješavanju praktičnih problema;
− razvijena sposobnost davanja kvantitativnih procjena i izračunavanja pomoću kemijskih formula i jednadžbi;
− poznavanje sigurnosnih pravila pri korištenju kemikalija;
− formiranje vlastitog stava u odnosu na kemijske informacije dobivene iz različitih izvora.
Oblik studija : individualno
Standardno vrijeme: 2 sata
Oprema radnog mjesta : Komplet modela molekula s kuglicom, tablica „Zasićeni ugljikovodici“, periodni sustav, nastavne tehnološke kartice, bilježnice
Književnost:
Sredstva obrazovanja: verbalni (verbalni), vizualni
Sigurnosne mjere: upoznati sa sigurnosnim pravilima na radnom mjestu iu uredu.
Smjernice
Ugljikovodici su organske tvari koje se sastoje od atoma ugljika i vodika. Atom ugljika u svim organskim spojevima je četverovalentan. Atomi ugljika mogu tvoriti ravne, razgranate i zatvorene lance. Svojstva tvari ne ovise samo o kvalitativnom i kvantitativnom sastavu, već i o redoslijedu kojim su atomi međusobno povezani. Tvari koje imaju istu molekulsku formulu, ali različite strukture nazivaju se izomeri. Prefiksi označavaju količinudi - dva,tri - tri,tetra - četiri;ciklo - znači zatvoreno.
Sufiksi u imenima ugljikovodika označavaju prisutnost višestruke veze:
hr
jednostruka veza između atoma ugljika(C - C);
hr
dvostruka veza između atoma ugljika(C = C);
u
trostruka veza između ugljikovih atoma(S
=
S);
dien
dvije dvostruke veze između atoma ugljika(C = C - C = C);
radikali:metil -CH 3 ; etil -C 2 N 5 ; klor -Cl; brom -Br.
Primjer. Napravite model molekule propana.
Molekula propanaC 3 H 8 sadrži tri atoma ugljika i osam atoma vodika. Atomi ugljika su međusobno povezani. Sufiks– en označava prisutnost jednostruke veze između ugljikovih atoma. Atomi ugljika nalaze se pod kutom od 109 28 minuta.
Molekula ima oblik piramide. Nacrtajte atome ugljika kao crne krugove, atome vodika kao bijele krugove, a atome klora kao zelene krugove.
Prilikom crtanja modela promatrajte omjer veličina atoma.
Pronađite molarnu masu pomoću periodnog sustava
M(S 3 N 8 ) = 12 · 3 + 1 · 8 = 44 g/mol.
Za imenovanje ugljikovodika potrebno je:
Odaberite najduži lanac.
Broj koji počinje od ruba kojemu je najbliža radikalna ili višestruka veza.
Navedite radikal ako je naznačeno više radikala. (Broj prije imena).
Imenujte radikal počevši od najmanjeg radikala.
Navedi najduži lanac.
Označite položaj višestruke veze. (Broj iza imena).
Primjer

Kada sastavljate formule po imenu, morate:
Odredite broj ugljikovih atoma u lancu.
Odredite položaj višestruke veze. (Broj iza imena).
Odredi položaj radikala. (Broj ispred imena).
Napiši formule radikala.
Na kraju odredite broj i raspored vodikovih atoma.
Radni nalog
Zadatak br. 1 . Napravite modele molekula:
1) niz alkana: metan, etan, butan, pentan, heksan, heptan, oktan, nonan i dekan;
2) Cikloalkani: ciklopropan,ciklopetan
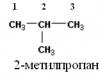
3) 2-metilpropan,
4) 1,2-dikloroetan.
Nacrtajte molekularne modele u svoju bilježnicu. Napiši strukturne formule tih tvari. Pronađite njihove molekularne težine.
Zadatak br. 2. Imenuj tvari:

Zadatak br. 3. Sastaviti strukturalni formule tvari:
a) buten-2, napišite njegov izomer;
b) 3,3-dimetilpentin-1.
Kontrolna pitanja
Koja je opća formula za zasićene ugljikovodike?
Koje tvari nazivamo homolozima, a koje izomerima?
Učitelj: Rachkovskaya A.I.
Organska kemija.
2.1.Tema: " Teorija strukture organskih spojeva"
2.1.1. Temeljni principi teorije strukture organskih spojeva i klasifikacija organskih spojeva.
1. Prirodne i sintetske organske tvari. Malo iz povijesti organske kemije. Opća svojstva organskih tvari (sastav, vrsta kemijske veze, kristalna struktura, topljivost, odnos prema zagrijavanju u prisutnosti kisika i bez njega).
2. Teorija strukture organskih spojeva A.M. Butlerova. Razvoj teorije i njezino značenje.
3. Klasifikacija organskih tvari.
Organske tvari dobile su svoje ime jer su prve od proučavanih tvari ove skupine bile dio živih organizama. Većina danas poznatih organskih tvari ne nalaze se u živim organizmima, već se dobivaju (sintetiziraju) u laboratoriju. Stoga se razlikuju prirodne (prirodne) organske tvari (iako se većina njih danas može dobiti u laboratoriju), te organske tvari koje ne postoje u prirodi - sintetske organske tvari. Oni. Naziv "organske tvari" je povijesni i nema puno značenja. Svi organski spojevi su ugljikovi spojevi. Organske tvari uključuju spojeve ugljika, osim jednostavnih tvari koje čine ugljik, njegovi oksidi, ugljična kiselina i njezine soli koje se proučavaju u anorganskoj kemiji. Drugim riječima: organska kemija je kemija ugljikovih spojeva.
Kratka povijest razvoja organizacijske kemije:
Berzelius, 1827., prvi udžbenik organske kemije. Vitalisti. Doktrina "životne sile".
Prve organske sinteze. Wöhler, 1824., sinteza oksalne kiseline i uree. Kolbe, 1845, octena kiselina. Berthelot, 1845, mast. Butlerov, 1861, šećerna tvar.
No, kao znanost, organska kemija započela je stvaranjem teorije o strukturi organskih spojeva. Značajan doprinos tome dali su njemački znanstvenik F.A.Kekule i Škot A.S.Cooper. Ali odlučujući doprinos nedvojbeno pripada ruskom kemičaru A.M.
Među svim elementima ugljik se ističe svojom sposobnošću stvaranja stabilnih spojeva u kojima su njegovi atomi međusobno povezani u dugačke lance različitih konfiguracija (linearni, razgranati, zatvoreni). Razlog za ovu sposobnost: približno ista energija veze C-C i C-O (za druge elemente energija sekunde je puno veća). Osim toga, atom ugljika može biti u jednoj od tri vrste hibridizacije, tvoreći jednostruke, dvostruke ili trostruke veze, ne samo međusobno, već i s atomima kisika ili dušika. Istina, puno češće (gotovo uvijek) atomi ugljika povezani su s atomima vodika. Ako organski spoj sadrži samo ugljik i vodik, spojevi se nazivaju ugljikovodici. Svi ostali spojevi mogu se smatrati derivatima ugljikovodika u kojima su neki atomi vodika zamijenjeni drugim atomima ili skupinama atoma. Dakle, preciznija definicija: Organski spojevi su ugljikovodici i njihovi derivati.
Postoji mnogo organskih spojeva - više od 10 milijuna (oko 500 tisuća anorganskih). Sastav, struktura i svojstva svih organskih tvari imaju mnogo toga zajedničkog.
Organske tvari imaju ograničeni kvalitativni sastav. Obavezno C i H, često O ili N, rjeđe halogeni, fosfor, sumpor. Ostali elementi su uključeni vrlo rijetko. Ali broj atoma u molekuli može doseći milijune, a molekularna težina može biti vrlo velika.
Struktura organskih spojeva. Jer sastav - nemetali. => Kemijska veza: kovalentna. Nepolarni i polarni. Ionski vrlo rijetko. => Kristalna rešetka najčešće molekularni.
Opća fizikalna svojstva: nisko vrelište i talište. Organske tvari uključuju plinove, tekućine i taljive čvrste tvari. Često je hlapljiv i može imati miris. Obično bezbojan. Većina organskih tvari je netopljiva u vodi.
Opća kemijska svojstva:
1) kada se zagrijavaju bez pristupa zraka, sve organske tvari postaju "pougljenjene", tj. pritom nastaje ugljen (točnije čađa) i neke druge anorganske tvari. Kovalentne veze se kidaju, prvo polarne, zatim nepolarne.
2) Zagrijavanjem u prisutnosti kisika sve organske tvari lako oksidiraju, a konačni produkti oksidacije su ugljikov dioksid i voda.
Značajke tijeka organskih reakcija. Organske reakcije uključuju molekule; tijekom reakcije neke kovalentne veze moraju se prekinuti, a druge formirati. Stoga, kemijske reakcije koje uključuju organske spojeve obično se odvijaju vrlo sporo; one zahtijevaju upotrebu povišene temperature, tlaka i katalizatora; reakcije se odvijaju vrlo brzo, ponekad trenutno, na normalnoj temperaturi. Organske reakcije rijetko rezultiraju visokim prinosima (obično manjim od 50%). Često su reverzibilne; osim toga, može se dogoditi ne jedna, već nekoliko reakcija koje se natječu jedna s drugom, što znači da će produkti reakcije biti mješavina različitih spojeva. Stoga je i oblik bilježenja organskih reakcija nešto drugačiji. Oni. ne koriste se kemijskim jednadžbama, već shemama kemijskih reakcija u kojima nema koeficijenata, ali su uvjeti reakcije detaljno naznačeni. Također je uobičajeno da se ispod jednadžbe zapisuju nazivi organizacija. tvari i vrsta reakcije.
Ali općenito, organske tvari i reakcije pokoravaju se općim zakonima kemije, a organske tvari se pretvaraju u anorganske ili mogu nastati iz anorganskih. Što još jednom naglašava jedinstvo svijeta oko nas.
Osnovni principi teorije kemijske strukture, koje je iznio mladi A.M. Butlerov na međunarodnom kongresu prirodnih znanstvenika 1861.
1). Atomi u molekulama međusobno su povezani određenim redoslijedom, u skladu sa svojom valencijom. Slijed kombinacije atoma naziva se kemijska struktura .
Valencija je sposobnost atoma da tvore određeni broj veza (kovalentnih). Valencija ovisi o broju nesparenih elektrona u atomu elementa jer kovalentne veze nastaju dijeljenjem elektronskih parova kada su elektroni upareni. Ugljik u svim organskim tvarima je četverovalentan. Vodik - 1, kisik - P, dušik - Š, sumpor - P, klor - 1.
Metode prikazivanja organskih molekula.
Molekularna formula je konvencionalni prikaz sastava tvari. H 2 CO 3 - ugljična kiselina, C 12 H 22 O 11 - saharoza. Takve formule su prikladne za izračune. Ali oni ne daju informacije o strukturi i svojstvima tvari. Stoga se čak i molekulske formule u organskim tvarima pišu na poseban način: CH 3 OH. Ali mnogo češće koriste strukturne formule. Strukturna formula odražava redoslijed kojim su atomi povezani u molekulu (tj. kemijsku strukturu). A u osnovi svake organske molekule je ugljikov kostur je lanac ugljikovih atoma međusobno povezanih kovalentnim vezama.
Elektronske formule molekula – veze među atomima prikazane su u parovima elektrona.
Potpuna strukturna formula prikazuje sve veze crticama. Kemijska veza koju tvori jedan par elektrona naziva se jednostruka veza i predstavljena je jednom linijom u strukturnoj formuli. Dvostruku vezu (=) tvore dva para elektrona. Trostruki (≡) čine tri para elektrona. A ukupan broj tih veza mora odgovarati valenciji elementa.
 U kondenziranoj strukturnoj formuli, crtice jednostrukih veza su izostavljene, a atomi povezani s jednim ili drugim atomom ugljika napisani su odmah iza njega (ponekad u zagradama).
U kondenziranoj strukturnoj formuli, crtice jednostrukih veza su izostavljene, a atomi povezani s jednim ili drugim atomom ugljika napisani su odmah iza njega (ponekad u zagradama).
Skeletne formule su još skraćenije. Ali oni se koriste rjeđe. Na primjer:

Strukturne formule odražavaju samo redoslijed spajanja atoma. Ali molekule organskih spojeva rijetko imaju ravnu strukturu. Trodimenzionalna slika molekule važna je za razumijevanje mnogih kemijskih reakcija. Slika molekule opisuje se pojmovima kao što su duljina veze i vezni kut. Osim toga, moguća je slobodna rotacija oko jednostrukih veza. Molekularni modeli pružaju vizualni prikaz.
7.1. Slika prikazuje pokus koji pokazuje da se tijela šire pri zagrijavanju. Olovkom zaokružite na slici predmet koji se zagrijavao u ovom pokusu – kuglicu ili prsten. Obrazložite svoj odgovor.
7.2. Odaberite točnu tvrdnju.
Prema suvremenim predodžbama, kada se tikvica s vodom ohladi, razina vode u cijevi opada jer... . 
7.3. Tvari se sastoje od sitnih čestica. Koje pojave i pokusi to potvrđuju?
7.4. Tablica prikazuje točne podatke o promjeni volumena vode V u ovisnosti o vremenu t tijekom zagrijavanja.
Odgovori na pitanja.
a) Može li se reći da se tijekom cijelog vremena promatranja voda u tikvici zagrijavala ravnomjerno? Objasni svoj odgovor.
b) Kako se mijenjao volumen vode pri zagrijavanju?

8.1. Odaberite točnu tvrdnju.
Ako nokat zagrijete, on se izdužuje i postaje deblji. To se događa jer kada se zagrije... . 
8.2. Napiši riječi molekula, kap, atom tako da svaki sljedeći element bude dio prethodnog.
8.3. Na slici su prikazani modeli molekula vode, kisika i ugljičnog dioksida. Sve molekule sadrže atom kisika (crno). Popunite praznine u tekstu.

8.4. Izmjerite duljinu svoje ruke od lakta do malog prsta i usporedite mjeru s veličinom molekule vode.
9.1. Popunite praznine u tekstu. “U ____, engleski botaničar Robert Brown, gledajući kroz mikroskop...”

9.2. Slika shematski prikazuje molekule tekućine koje okružuju zrno boje stavljeno u tu tekućinu. Strelice pokazuju smjer kretanja molekula tekućine u određenom trenutku u vremenu.

9.3. Navedite one pojave koje su primjeri Brownovog gibanja.
9.4. Na slici je prikazana isprekidana linija duž koje se nekoliko sekundi u zraku kretala čestica prašine.

a) Objasnite zašto je zrnca prašine tijekom promatranja mnogo puta promijenila smjer kretanja.
Zbog sudara s molekulama zraka i drugim česticama prašine.
b) Na slici označite točke u kojima su česticu prašine zahvatile molekule koje je okružuju.
10.1. Čista voda se ulije u stakleni cilindar odozgo, a otopina bakrenog sulfata se ulije na dno kroz usku cijev. Cilindar miruje kada stalna temperatura. Pokažite na slici kako će sadržaj cilindra izgledati u različitim intervalima.

10.2. Dvije identične gumene kuglice spojene su prozirnim crijevom (vidi sliku), a lijeva kuglica je u oba slučaja napunjena vodikom (obojite vodik plavo), desna je prazna na slici a, a napunjena je zrakom na slici b (obojite zrak u zeleno). Crijevo je stegnuto između kuglica.

10.3. Precrtajte jednu od označenih riječi kako biste dovršili ispravno objašnjenje opisanog pokusa.

10.4. Kućni eksperiment.
Stavite komadić šećera na dno čaše hladne vode, ali ne miješajte. Zapišite koliko vam je vremena trebalo da otkrijete prisutnost molekula šećera na površini vode u čaši i koji ste “uređaj” koristili.
11.1. Popunite praznine u tekstu riječima: jači; slabiji; privlačnost; odbijanje.

11.2. Crtama poveži pojave i njihova odgovarajuća objašnjenja.

11.3. Precrtajte jednu od označenih riječi kako biste dovršili ispravno objašnjenje opisanog pokusa.

11.4. Dopunite rečenicu kako biste dobili ispravno objašnjenje pojave.
11.5. Popunite praznine u tekstu. “U svakodnevnom životu često se susrećemo s fenomenima vlaženja i nekvašenja.”

12.1. Koje agregatno stanje karakteriziraju navedene karakteristike?