pierwsza to cząsteczka wody, druga to cząsteczka dwutlenku węgla, trzecia to cząsteczka metanu, czwarta to cząsteczka dwutlenku siarki.
Witam, proszę o pomoc w rozwiązaniu zadania 2 z chemii8 klasa
na temat „Proste substancje. Ilość substancji."
Opcja 1.
A1. Znak pierwiastka tworzącego substancję prostą – niemetal:
1) Na 2) C 3) K 4) Al
A2. Prosta substancja – metal:
1) tlen 2) miedź 3) fosfor 4) siarka
A3. Stan fizyczny rtęci prostej w normalnym stanie
warunki:
1) ciało stałe 2) ciecz 3) gaz
A4. Wiązanie chemiczne jest kowalencyjne niepolarne
w istocie:
1) żelazo 2) chlor 3) woda 4) miedź
A5. Alotropowa modyfikacja tlenu:
1) grafit 2) fosfor biały 3) ozon 4) węgiel
A6. Oznaczenie 3O2 oznacza:
1) 2 cząsteczki tlenu
2) 3 cząsteczki tlenu
3) 5 atomów tlenu
4) 6 atomów tlenu
A7. Masa 3 moli siarkowodoru H2S jest równa:
1) 33 2) 34 3) 99 4) 102
A8. Objętość zajmowana przez 2 mole substancji gazowej
wzór SO2 (n.s):
1)22,4 l. 2) 33,6 l. 3) 44,8 l. 4) 67,2 l.
A9. Grupa substancji z jonowym typem wiązania chemicznego:
1) Cl2, H2, O2 2) KCl, NaBr, CaI2
3) H2O, CO2, NaCl 4) K2O, MgO, NaI
A10. Objętość molowa jest. . .
1) objętość dowolnego gazu pod nr. 2) objętość 2 g dowolnego gazu w temperaturze zerowej
3) objętość 1 mola dowolnego gazu w nr 4) objętość 12 * 1023 cząsteczek w nr.
A11. 3 cząsteczki chloru:
1)3Cl2 2)3Cl 3)Cl2 4)6Cl
Pytanie 1. Zidentyfikuj twardą, miękką substancję, która pozostawia ślad na papierze, ma lekko metaliczny połysk i przewodzi prąd elektryczny:
1) diament 2) węgiel 3) grafit 4) biały fosfor
O 2. Liczba cząsteczek w 2 mmol wody wynosi:
1) 12*1023. 2) 12*1020. 3) 18*1020 4) 12*1018
O 3. Substancje ułożone w rosnącej kolejności według niemetali
nieruchomości:
1) K, Na, Rb, Li 2) Li, Na K, Rb 3) Rb, K, Na, Li 4) Na, Rb, K, Li
C1. Oblicz objętość 140 kg. azot N2 pod nr.
A.Na B.C. C.K D.Al
2) Prosta substancja - metal:
A. tlen B. Miedź C. Fosfor D. Siarka
3) Stan fizyczny rtęci prostej w normalnych warunkach:
A. Ciało stałe B. Ciecz C. Gaz
4) Wiązanie chemiczne w substancji jest kowalencyjne niepolarne:
A. Żelazo B. Ciecz C. Gaz
5) Alotropowa modyfikacja tlenu:
A. Grafit B. Ozon
B. Fosfor biały D. Diament
6) Atom pierwiastka tworzącego prostą substancję - metal odpowiada schematowi elektronicznemu:
A. +18))) B. +3)) C. +6)) D. +15)))
288 21 24 285
7) Wpis ZO2 oznacza:
A. 2 cząsteczki tlenu
B. 3 cząsteczki tlenu
B. 5 atomów tlenu
D. 3 atomy tlenu
8) Masa 3 moli siarkowodoru H2S jest równa: (z roztworem)
A. 33 g. B. 34 g. C. 99 g. D. 102 g.
9) Objętość zajmowana przez 2 mole substancji gazowej o wzorze SO2 (n.s.): (z roztworem)
A. 22,4 l. B. 33,6 l. wys. 44,8 l. G. 67,2 l.
10) ilość dwutlenku węgla CO2, który zawiera 36*10(23) cząsteczek, jest równa: (z roztworem)
11) Mecz:
Rodzaj wiązania chemicznego:
1. Jonowy B. Kowalentny polarny C. Metaliczny
Wzór chemiczny substancji:
A.CI2 B.K C.NaCI D.Fe D.NH3
12) Oblicz objętość tlenu O2 o masie 160 g (nr) (z roztworem)
13) Uzupełnij definicję: „Alotropia jest zjawiskiem…”
14) Wybierz właściwości charakteryzujące grafit.
Ciężki, twardy, trudny
B. Miękkie, pozostawia ślady na papierze.
B. Bezbarwny, przezroczysty.
D. Ma lekki metaliczny połysk
D. Przewodzący elektrycznie.
elektrony poziomu 3?
1) Mg i Al 2) O i S 3) N i S 4) B i Al
2. Atom pierwiastka tworzącego prostą substancję - niemetal - odpowiada
obwód elektryczny?
1) +11)2)8)1 2) +8)2)6 3) +12)2)8)2 4) +4)2)2
3. Azot wykazuje najwyższy stopień utlenienia w połączeniu ze wzorem:
1) NO2 2)NO 3)NH3 4)N2O5
4. Która substancja ma kowalencyjne wiązanie niepolarne?
1) O2 2) H2O 3) CaCl2 4) Ba
5. Wzór elektroniczny 1s2 2s2 2p1 odpowiada atomowi:
1) beryl 2) krzem 3) węgiel 4) bor
6. Wraz ze wzrostem ładunku jąder atomowych w szeregu F -Cl - Br -I, niemetaliczny
nieruchomości?
1) nasilać 2) osłabiać 3) nie zmieniać 4) zmieniać okresowo
7. podać wzór związku z kowalencyjnym polarnym wiązaniem chemicznym:
1) H2 2) NH3 3) Ca3N2 4) C
8. Stopień utlenienia fosforu w związkach odpowiednio P2O5, PH3, Ca3P2
równy?
1) +3, -3, +5 2) -3, +3, +5 3) +5, +5, -3 4) +5, -3, -3
9. Czy poniższe stwierdzenia są prawdziwe?
A. W okresie właściwości metaliczne atomów pierwiastków o rosnącym rzędzie
liczby są coraz silniejsze.
B. W okresie właściwości metaliczne atomów pierwiastków o rosnącym rzędzie
liczby słabną.
1) tylko A jest prawdziwe 2) oba sądy są prawdziwe 3) tylko B jest prawdziwe 4) oba sądy nie są
są prawdziwe
10. Pierwiastek chemiczny, w atomie którego elektrony są rozmieszczone pomiędzy warstwami w następujący sposób:
2,8,8,2, w układzie okresowym znajduje się:
A) w 4. okresie, 2. grupa, podgrupa wtórna
B) w 4. okresie, 2. grupa głównej podgrupy
B) w 3. okresie, 5. grupa głównej podgrupy
D) w 3. okresie, 5. grupie, podgrupie wtórnej
chemia organiczna, izoologia cząsteczek
Obecnie powszechnie przyjmuje się, że jedna linia prosta łącząca dwa atomy oznacza jedno wiązanie dwuelektronowe (wiązanie pojedyncze), którego utworzenie wymaga jednej wartościowości z każdego ze związanych atomów, dwie linie - jedno wiązanie czteroelektronowe (wiązanie podwójne), trzy linie - jedno wiązanie sześcioelektronowe (wiązanie potrójne).
Reprezentację związku o znanej kolejności wiązań pomiędzy wszystkimi atomami za pomocą wiązań tego typu nazywa się wzorem strukturalnym:
Aby zaoszczędzić czas i miejsce, często stosuje się skrócone formuły, w których niektóre połączenia są ukryte, ale nie zapisane:
Czasami, zwłaszcza w szeregach karbocyklicznych i heterocyklicznych, wzory są jeszcze bardziej uproszczone: nie tylko niektóre wiązania nie są zapisane, ale także niektóre atomy węgla i wodoru nie są przedstawione, a jedynie dorozumiane (na przecięciach linii) ; uproszczone formuły:
Tetraedryczny model atomu węgla
Podstawowe koncepcje budowy chemicznej sformułowane przez A. M. Butlerowa uzupełnili Van't Hoff i Le Bel (1874), którzy rozwinęli ideę przestrzennego rozmieszczenia atomów w cząsteczce substancji organicznej i podnieśli kwestia konfiguracji przestrzennej i konformacji cząsteczek. Praca Van't Hoffa „Chemia w kosmosie” (1874) zapoczątkowała owocny kierunek w chemii organicznej - stereochemię, tj. badanie struktury przestrzennej.
Ryż. 1 - Modele Van't Hoffa: metan (a), etan (b), etylen (c) i acetylen (d)
Van't Hoff zaproponował czworościenny model atomu węgla. Zgodnie z tą teorią cztery wartościowości atomu węgla w metanie są skierowane w stronę czterech narożników czworościanu, w środku którego znajduje się atom węgla, a na wierzchołkach atomy wodoru (a). Etan, według Van't Hoffa, można sobie wyobrazić jako dwa czworościany połączone wierzchołkami i swobodnie obracające się wokół wspólnej osi (6). Model cząsteczki etylenu przedstawia dwa czworościany połączone krawędziami (c), a cząsteczki z wiązaniem potrójnym reprezentuje model, w którym czworościany stykają się z płaszczyznami (d).
Modele tego typu okazały się również bardzo skuteczne w przypadku złożonych cząsteczek. Są one dziś z powodzeniem stosowane do wyjaśnienia szeregu zagadnień stereochemicznych. Teoria zaproponowana przez Van't Hoffa, choć odpowiednia niemal we wszystkich przypadkach, nie dawała jednak rozsądnego wyjaśnienia rodzaju i istoty sił wiązania w cząsteczkach.
Innowacyjna droga do rozwoju technologii tworzenia nowych leków
W pierwszej kolejności tworzony jest komputerowy model obiektu, a modelowanie komputerowe wykorzystuje się także do formowania cząsteczek na stanowisku badawczym. Model może być dwuwymiarowy lub trójwymiarowy...
Widma w podczerwieni cząsteczek
W przeciwieństwie do zakresów widzialnego i ultrafioletowego, które powstają głównie w wyniku przejść elektronów z jednego stanu stacjonarnego do drugiego...
Badanie struktury związków organicznych metodami fizycznymi
Wszystkie możliwe pozycje cząsteczek w przestrzeni trójwymiarowej sprowadzają się do ruchu translacyjnego, obrotowego i wibracyjnego. Cząsteczka składająca się z N atomów ma tylko 3N stopni swobody ruchu...
Metoda modelowania w chemii
Obecnie można spotkać wiele różnych definicji pojęć „model” i „symulacja”. Przyjrzyjmy się niektórym z nich. „Model rozumiany jest jako reprezentacja faktów, rzeczy i zależności z określonej dziedziny wiedzy w postaci prostszej...
Naukowe podstawy reologii
Stan naprężenia-odkształcenia ciała jest na ogół trójwymiarowy i opisanie jego właściwości za pomocą prostych modeli jest nierealne. Jednakże w tych rzadkich przypadkach, gdy ciała jednoosiowe są zdeformowane...
Oprócz obserwacji i eksperymentów modelowanie odgrywa ważną rolę w zrozumieniu świata przyrody i chemii. Jednym z głównych celów obserwacji jest poszukiwanie wzorców w wynikach eksperymentów...
Rozpuszczanie ciał stałych
W zdecydowanej większości procesów funkcja kinetyczna jest niezmienna w zależności od stężenia aktywnego odczynnika i temperatury. Innymi słowy, każda wartość bezwymiarowego czasu x odpowiada bardzo określonej wartości...
Obliczanie parametrów chemii kwantowej PAS i wyznaczanie zależności struktura-aktywność na przykładzie sulfonamidów
Refraktometryczne metody analizy w chemii
Synteza i analiza substancji chemicznych w produkcji benzyn
Model chemiczny procesu krakingu katalitycznego jest bardzo złożony. Rozważmy najprostszą z reakcji zachodzących podczas procesu krakingu: CnH2n+2 > CmH2m+2 + CpH2p...
Synteza chemicznego układu technologicznego (CTS)
Procesy produkcyjne różnią się cechami i stopniem złożoności. Jeżeli proces jest złożony i rozszyfrowanie jego mechanizmu wymaga dużego wysiłku i czasu, stosuje się podejście empiryczne. Modele matematyczne...
Porównanie reaktorów tłokowych i pełnego mieszania w trybie pracy izotermicznej
GBPOU NSO „Kolyvan Agrarian College”
Instruktażowa mapa technologiczna nr 1
według OUD. jedenaście Chemia
zawody 35.01.23 Pani majątku, 19.01.04 Baker
Sekcja 1: Chemia organiczna
Temat 1.1: Podstawowe pojęcia chemii organicznej i teoria budowy związków organicznych.
Stanowisko : Wykonywanie modeli cząsteczek - przedstawicieli różnych klas związków organicznych.
Cel pracy:
uogólniać i systematyzować wiedzę studentów na temat teorii budowy związków organicznych;
utrwalić umiejętność komponowania wzorów strukturalnych węglowodorów;
Uczeń musi osiągnąć następujące wyniki:
osobisty:
− poczucie dumy i szacunku dla historii i osiągnięć krajowej chemii; chemicznie kompetentne zachowanie w działalności zawodowej i w domu podczas obchodzenia się z chemikaliami, materiałami i procesami;
− gotowość do kontynuowania nauki i doskonalenia zawodowego w wybranej działalności zawodowej oraz obiektywna świadomość roli w tym kompetencji chemicznych;
− umiejętność wykorzystania osiągnięć współczesnej nauki chemicznej i technologii chemicznych dla doskonalenia własnego rozwoju intelektualnego w wybranej działalności zawodowej;
metatemat:
− wykorzystanie różnego rodzaju aktywności poznawczej i podstawowych operacji intelektualnych (stwierdzenie problemu, formułowanie hipotez, analiza i synteza, porównanie, uogólnienie, systematyzacja, identyfikacja związków przyczynowo-skutkowych, poszukiwanie analogii, formułowanie wniosków) do rozwiązać problem, zastosować podstawowe metody poznania (obserwacja, eksperyment naukowy) do badania różnych aspektów obiektów i procesów chemicznych, z którymi trzeba się spotkać na polu zawodowym;
− korzystanie z różnych źródeł w celu uzyskania informacji chemicznej, umiejętność oceny jej wiarygodności w celu osiągnięcia dobrych wyników w dziedzinie zawodowej;
temat :
− kształtowanie się wyobrażeń o miejscu chemii we współczesnym naukowym obrazie świata;
Zrozumienie roli chemii w kształtowaniu horyzontów człowieka i umiejętności funkcjonalnych w rozwiązywaniu problemów praktycznych;
− opanowanie podstawowych pojęć, teorii, praw i wzorców chemicznych;
Pewne posługiwanie się terminologią i symbolami chemicznymi;
− opanowanie podstawowych metod wiedzy naukowej stosowanych w chemii: obserwacja, opis, pomiar, doświadczenie;
Umiejętność przetwarzania, wyjaśniania wyników eksperymentów i wyciągania wniosków;
− chęć i umiejętność stosowania metod poznawczych w rozwiązywaniu problemów praktycznych;
− rozwinięta umiejętność dokonywania szacunków ilościowych i wykonywania obliczeń z wykorzystaniem wzorów i równań chemicznych;
− znajomość zasad bezpieczeństwa podczas stosowania środków chemicznych;
− kształtowanie własnego stanowiska w stosunku do informacji chemicznych uzyskanych z różnych źródeł.
Forma studiów : indywidualny
Czas standardowy: 2 godziny
Wyposażenie miejsca pracy : Zestaw kulkowych modeli cząsteczek, tablica „Węglowodory nasycone”, układ okresowy, instruktażowe karty technologiczne, zeszyty
Literatura:
Środki edukacji: werbalny (werbalny), wizualny
Środki ostrożności: zapoznał się z zasadami bezpieczeństwa w miejscu pracy i biurze.
Wytyczne
Węglowodory to substancje organiczne składające się z atomów węgla i wodoru. Atom węgla we wszystkich związkach organicznych jest czterowartościowy. Atomy węgla mogą tworzyć łańcuchy proste, rozgałęzione i zamknięte. Właściwości substancji zależą nie tylko od składu jakościowego i ilościowego, ale także od kolejności, w jakiej atomy są ze sobą połączone. Substancje, które mają ten sam wzór cząsteczkowy, ale różne struktury, nazywane są izomerami. Przedrostki wskazują ilośćdi - dwa,trzy - trzy,tetra - cztery;cykl - oznacza zamknięte.
Przyrostki w nazwach węglowodorów wskazują na obecność wiązania wielokrotnego:
pl
wiązanie pojedyncze między atomami węgla(C - C);
pl
podwójne wiązanie między atomami węgla(C = C);
W
potrójne wiązanie między atomami węgla(Z
=
Z);
dien
dwa wiązania podwójne pomiędzy atomami węgla(C = C - C = C);
Radykałowie:metyl -CH 3 ; etyl -C 2 N 5 ; chlor -Cl; brom -Br.
Przykład. Zrób model cząsteczki propanu.
Cząsteczka propanuC 3 H 8 zawiera trzy atomy węgla i osiem atomów wodoru. Atomy węgla są ze sobą połączone. Przyrostek– pl wskazuje na obecność pojedynczego wiązania między atomami węgla. Atomy węgla są ułożone pod kątem 109 28 minuty.
Cząsteczka ma kształt piramidy. Narysuj atomy węgla jako czarne kółka, atomy wodoru jako białe kółka i atomy chloru jako zielone kółka.
Rysując modele, należy zwrócić uwagę na stosunek rozmiarów atomów.
Znajdź masę molową, korzystając z układu okresowego
SM 3 N 8 ) = 12 · 3 + 1 · 8 = 44 g/mol.
Aby nazwać węglowodór, musisz:
Wybierz najdłuższy łańcuch.
Liczba rozpoczynająca się od krawędzi, do której najbliżej jest rodnik lub wiązanie wielokrotne.
Wskaż rodnik, jeśli wskazano kilka rodników. (Numer przed imieniem).
Nazwij rodnik, zaczynając od najmniejszego rodnika.
Podaj nazwę najdłuższego łańcucha.
Wskaż położenie wiązania wielokrotnego. (Numer po imieniu).
Przykład

Tworząc formuły według nazwy, musisz:
Określ liczbę atomów węgla w łańcuchu.
Określ położenie wiązania wielokrotnego. (Numer po imieniu).
Określ położenie rodników. (Numer przed imieniem).
Zapisz wzory pierwiastków.
Na koniec określ liczbę i rozmieszczenie atomów wodoru.
Porządek pracy
Zadanie nr 1 . Utwórz modele cząsteczek:
1) szereg alkanów: metan, etan, butan, pentan, heksan, heptan, oktan, nonan i dekan;
2) Cykloalkany: cyklopropan,cyklopetan
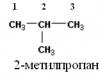
3) 2-metylopropan,
4) 1,2-dichloroetan.
Narysuj modele molekularne w swoim notatniku. Zapisz wzory strukturalne tych substancji. Znajdź ich masy cząsteczkowe.
Zadanie nr 2. Nazwij substancje:

Zadanie nr 3. Komponować strukturalny wzory substancji:
a) buten-2, napisz jego izomer;
b) 3,3 - dimetylopentyna-1.
Pytania kontrolne
Podaj wzór ogólny węglowodorów nasyconych.
Które substancje nazywamy homologami, a które izomerami?
Nauczyciel: Rachkovskaya A.I.
Chemia organiczna.
2.1.Temat: " Teoria budowy związków organicznych”
2.1.1. Podstawowe zasady teorii budowy związków organicznych i klasyfikacji związków organicznych.
1. Naturalne i syntetyczne substancje organiczne. Trochę z historii chemii organicznej. Ogólne właściwości substancji organicznych (skład, rodzaj wiązania chemicznego, struktura krystaliczna, rozpuszczalność, związek z ogrzewaniem w obecności tlenu i bez niego).
2. Teoria struktury związków organicznych A.M. Butlerowa. Rozwój teorii i jej znaczenie.
3. Klasyfikacja substancji organicznych.
Substancje organiczne otrzymały swoją nazwę, ponieważ pierwsza z badanych substancji z tej grupy była częścią organizmów żywych. Większość znanych obecnie substancji organicznych nie występuje w organizmach żywych; są one otrzymywane (syntetyzowane) w laboratorium. Dlatego rozróżnia się naturalne (naturalne) substancje organiczne (choć większość z nich można obecnie uzyskać w laboratorium) oraz substancje organiczne, które nie występują w przyrodzie - syntetyczne substancje organiczne. Te. Nazwa „substancje organiczne” ma charakter historyczny i nie ma większego znaczenia. Wszystkie związki organiczne są związkami węgla. Do substancji organicznych zalicza się związki węgla, z wyjątkiem prostych substancji utworzonych przez węgiel, jego tlenki, kwas węglowy i jego sole badane w toku chemii nieorganicznej. Innymi słowy: chemia organiczna to chemia związków węgla.
Krótka historia rozwoju chemii organizacyjnej:
Berzelius, 1827, pierwszy podręcznik chemii organicznej. Witaliści. Doktryna „siły życiowej”.
Pierwsze syntezy organiczne. Wöhler, 1824, synteza kwasu szczawiowego i mocznika. Kolbe, 1845, kwas octowy. Berthelot, 1845, gruby. Butlerov, 1861, substancja słodka.
Ale jako nauka chemia organiczna rozpoczęła się od stworzenia teorii struktury związków organicznych. Znaczący wkład w to wnieśli niemiecki naukowiec F.A. Kekule i Szkot A.S. Cooper. Ale decydujący wkład niewątpliwie należy do rosyjskiego chemika A.M. Butlerowa.
Spośród wszystkich pierwiastków węgiel wyróżnia się zdolnością do tworzenia stabilnych związków, w których jego atomy są połączone ze sobą w długie łańcuchy o różnej konfiguracji (liniowe, rozgałęzione, zamknięte). Powód tej zdolności: w przybliżeniu taka sama energia wiązania C-C i C-O (w przypadku innych pierwiastków energia drugiego jest znacznie wyższa). Ponadto atom węgla może znajdować się w jednym z trzech rodzajów hybrydyzacji, tworząc odpowiednio wiązania pojedyncze, podwójne lub potrójne nie tylko między sobą, ale także z atomami tlenu lub azotu. To prawda, że znacznie częściej (prawie zawsze) atomy węgla są połączone z atomami wodoru. Jeśli związek organiczny zawiera tylko węgiel i wodór, związki te nazywane są węglowodorami. Wszystkie inne związki można uznać za pochodne węglowodorów, w których niektóre atomy wodoru zastąpiono innymi atomami lub grupami atomów. Dlatego bardziej precyzyjna definicja: Związki organiczne to węglowodory i ich pochodne.
Związków organicznych jest bardzo dużo – ponad 10 milionów (około 500 tysięcy nieorganicznych). Skład, struktura i właściwości wszystkich substancji organicznych mają ze sobą wiele wspólnego.
Substancje organiczne mają ograniczony skład jakościowy. Koniecznie C i H, często O lub N, rzadziej halogeny, fosfor, siarka. Pozostałe elementy dołączane są bardzo rzadko. Ale liczba atomów w cząsteczce może sięgać milionów, a masa cząsteczkowa może być bardzo duża.
Struktura związków organicznych. Ponieważ skład - niemetale. => Wiązanie chemiczne: kowalencyjne. Niepolarne i polarne. Jonowe bardzo rzadko. => Najczęściej sieć krystaliczna molekularny.
Ogólne właściwości fizyczne: niska temperatura wrzenia i topnienia. Substancje organiczne obejmują gazy, ciecze i topliwe ciała stałe. Często lotny i może mieć zapach. Zwykle bezbarwny. Większość substancji organicznych jest nierozpuszczalna w wodzie.
Ogólne właściwości chemiczne:
1) po podgrzaniu bez dostępu powietrza wszystkie substancje organiczne ulegają „zwęgleniu”, tj. w tym przypadku powstaje węgiel (dokładniej sadza) i niektóre inne substancje nieorganiczne. Wiązania kowalencyjne są zrywane, najpierw polarne, potem niepolarne.
2) Po podgrzaniu w obecności tlenu wszystkie substancje organiczne łatwo ulegają utlenieniu, a końcowymi produktami utleniania są dwutlenek węgla i woda.
Cechy przebiegu reakcji organicznych. Reakcje organiczne obejmują cząsteczki; podczas reakcji niektóre wiązania kowalencyjne muszą zostać zerwane, a inne utworzone. Dlatego reakcje chemiczne z udziałem związków organicznych zwykle przebiegają bardzo powoli; wymagają zastosowania podwyższonej temperatury, ciśnienia i katalizatorów. Reakcje nieorganiczne zwykle przebiegają z udziałem jonów, czasami natychmiast, w normalnej temperaturze. Reakcje organiczne rzadko dają wysoką wydajność (zwykle poniżej 50%). Często są one odwracalne, ponadto może zachodzić nie jedna, ale kilka reakcji, konkurując ze sobą, co oznacza, że produkty reakcji będą mieszaniną różnych związków. Dlatego też forma rejestracji reakcji organicznych jest również nieco inna. Te. nie używają równań chemicznych, ale schematy reakcji chemicznych, w których nie ma współczynników, ale szczegółowo wskazano warunki reakcji. Zwyczajowo zapisuje się również nazwy organizacji pod równaniem. Substancje i rodzaj reakcji.
Ale ogólnie rzecz biorąc, substancje i reakcje organiczne podlegają ogólnym prawom chemii, a substancje organiczne zamieniają się w substancje nieorganiczne lub mogą powstawać z substancji nieorganicznych. Co po raz kolejny podkreśla jedność otaczającego nas świata.
Podstawowe zasady teorii struktury chemicznej, określone przez młodego A.M. Butlerowa na międzynarodowym kongresie przyrodników w 1861 r.
1). Atomy w cząsteczkach są połączone ze sobą w określonej kolejności, zgodnie z ich wartościowością. Kolejność kombinacji atomów nazywa się strukturą chemiczną .
Wartościowość to zdolność atomów do tworzenia określonej liczby wiązań (kowalencyjnych). Wartościowość zależy od liczby niesparowanych elektronów w atomie pierwiastka, ponieważ wiązania kowalencyjne powstają poprzez wspólne pary elektronów, gdy elektrony są sparowane. Węgiel we wszystkich substancjach organicznych jest czterowartościowy. Wodór - 1, Tlen - P, azot - Ш, siarka - P, chlor - 1.
Metody przedstawiania cząsteczek organicznych.
Wzór cząsteczkowy jest konwencjonalnym przedstawieniem składu substancji. H 2 CO 3 - kwas węglowy, C 12 H 22 O 11 - sacharoza. Takie formuły są wygodne do obliczeń. Nie dostarczają jednak informacji o strukturze i właściwościach substancji. Dlatego nawet wzory molekularne w substancjach organicznych są zapisywane w specjalny sposób: CH 3 OH. Ale znacznie częściej używają wzorów strukturalnych. Wzór strukturalny odzwierciedla kolejność, w jakiej atomy są połączone w cząsteczce (tj. strukturę chemiczną). A podstawą każdej cząsteczki organicznej jest szkielet węglowy to łańcuch atomów węgla połączonych wiązaniami kowalencyjnymi.
Elektroniczne wzory cząsteczek - wiązania między atomami pokazano w parach elektronów.
Pełny wzór strukturalny pokazuje wszystkie połączenia za pomocą myślników. Wiązanie chemiczne utworzone przez jedną parę elektronów nazywa się wiązaniem pojedynczym i jest reprezentowane przez pojedynczą linię we wzorze strukturalnym. Wiązanie podwójne (=) tworzą dwie pary elektronów. Potrójny (≡) tworzą trzy pary elektronów. Całkowita liczba tych wiązań musi odpowiadać wartościowości pierwiastka.
 W skondensowanym wzorze strukturalnym kreski pojedynczych wiązań są pomijane, a atomy związane z jednym lub drugim atomem węgla są zapisywane bezpośrednio po nim (czasami w nawiasach).
W skondensowanym wzorze strukturalnym kreski pojedynczych wiązań są pomijane, a atomy związane z jednym lub drugim atomem węgla są zapisywane bezpośrednio po nim (czasami w nawiasach).
Wzory szkieletowe są jeszcze bardziej skrócone. Ale są używane rzadziej. Na przykład:

Wzory strukturalne odzwierciedlają jedynie kolejność łączenia atomów. Ale cząsteczki związków organicznych rzadko mają płaską strukturę. Trójwymiarowy obraz cząsteczki jest ważny dla zrozumienia wielu reakcji chemicznych. Obraz cząsteczki opisuje się za pomocą takich pojęć, jak długość wiązania i kąt wiązania. Dodatkowo możliwa jest swobodna rotacja wokół wiązań pojedynczych. Modele molekularne zapewniają wizualną reprezentację.
7.1. Rysunek przedstawia doświadczenie ilustrujące, że ciała rozszerzają się pod wpływem ogrzewania. Zakreśl długopisem na obrazku przedmiot, który był podgrzewany w tym eksperymencie – kulkę lub pierścień. Uzasadnij swoją odpowiedź.
7.2. Wybierz prawidłowe stwierdzenie.
Według współczesnych koncepcji, gdy kolba z wodą się ochładza, poziom wody w rurce spada, ponieważ... . 
7.3. Substancje składają się z drobnych cząstek. Jakie zjawiska i eksperymenty to potwierdzają?
7.4. W tabeli przedstawiono dokładne dane dotyczące zmiany objętości wody V w funkcji czasu t podczas ogrzewania.
Odpowiedz na pytania.
a) Czy można powiedzieć, że przez cały czas obserwacji woda w kolbie podgrzewała się równomiernie? Wyjaśnij swoją odpowiedź.
b) Jak zmieniła się objętość wody po podgrzaniu?

8.1. Wybierz prawidłowe stwierdzenie.
Podgrzany paznokieć wydłuża się i staje się grubszy. Dzieje się tak, ponieważ po podgrzaniu... . 
8.2. Zapisz słowa molekuła, kropla, atom w takiej kolejności, aby każdy kolejny element był częścią poprzedniego.
8.3. Rysunek przedstawia modele cząsteczek wody, tlenu i dwutlenku węgla. Wszystkie cząsteczki zawierają atom tlenu (czarny). Wypełnij puste miejsca w tekście.

8.4. Zmierz długość ramienia od łokcia do małego palca i porównaj wynik z wielkością cząsteczki wody.
9.1. Wypełnij puste miejsca w tekście. „W ____ angielski botanik Robert Brown patrząc przez mikroskop…”

9.2. Rysunek schematycznie przedstawia cząsteczki cieczy otaczające ziarno farby umieszczone w tej cieczy. Strzałki wskazują kierunek ruchu cząsteczek cieczy w określonym momencie.

9.3. Wymień zjawiska będące przykładami ruchów Browna.
9.4. Na rysunku widać przerywaną linię, wzdłuż której przez kilka sekund poruszała się w powietrzu drobina kurzu.

a) Wyjaśnij, dlaczego pyłek kurzu podczas obserwacji wielokrotnie zmieniał kierunek swego ruchu.
W wyniku zderzeń z cząsteczkami powietrza i innymi cząsteczkami pyłu.
b) Wskaż na rysunku punkty, w których cząsteczka pyłu została dotknięta przez otaczające ją cząsteczki.
10.1. Czystą wodę wlewa się do szklanego cylindra od góry, a roztwór siarczanu miedzi wlewa się na dno przez wąską rurkę. Cylinder jest w spoczynku, gdy stała temperatura. Pokaż na rysunku, jak będzie wyglądać zawartość cylindra w różnych odstępach czasu.

10.2. Dwie identyczne gumowe kulki są połączone przezroczystym wężem (patrz rysunek), lewa kula w obu przypadkach jest wypełniona wodorem (pokoloruj wodór na niebiesko), prawa jest pusta na rysunku a i wypełniona powietrzem na rysunku b (pokoloruj powietrze na zielono). Wąż jest zaciśnięty pomiędzy kulami.

10.3. Przekreśl jedno z wyróżnionych słów, aby uzupełnić prawidłowe wyjaśnienie opisanego doświadczenia.

10.4. Domowy eksperyment.
Kawałek cukru umieść na dnie szklanki zimnej wody, ale nie mieszaj. Zapisz, ile czasu zajęło Ci wykrycie obecności cząsteczek cukru na powierzchni wody w szklance i jakiego „urządzenia” użyłeś.
11.1. Uzupełnij luki w tekście, używając słów: silniejszy; słabszy; atrakcja; odpychanie.

11.2. Połącz zjawiska i odpowiadające im wyjaśnienia liniami.

11.3. Przekreśl jedno z wyróżnionych słów, aby uzupełnić prawidłowe wyjaśnienie opisanego doświadczenia.

11.4. Dokończ zdanie, aby uzyskać prawidłowe wyjaśnienie zjawiska.
11,5. Wypełnij puste miejsca w tekście. „W życiu codziennym często spotykamy się ze zjawiskami zwilżania i braku zwilżania.”

12.1. Jaki stan skupienia charakteryzuje się wymienionymi cechami?